Биохимические процессы, происходящие в организме
Содержание:
- Биохимия ферментов основана на их строении
- Причины интенсивного развития биохимии и дочерних наук
- Архивы
- Особенности метаболизма по ГН
- Экстремофилы и промышленность
- Классификация ферментов
- Энзимопатология
- Активность ферментов
- Биохимическая реакция
- Функции энзимов в клетке
- Бизнес и финансы
- Современные разделы биохимии
- Этапы расщепления сахаридов
- Значение
- Роль ферментов в организме
Биохимия ферментов основана на их строении
Способности каждого энзима определяются индивидуальным, только ему свойственным строением. Любой фермент – это, прежде всего, белок, и его структура и степень сворачивания играют решающую роль в определении его функции.
Для каждого биокатализатора характерно наличие активного центра, который, в свою очередь, делится на несколько самостоятельных функциональных областей:
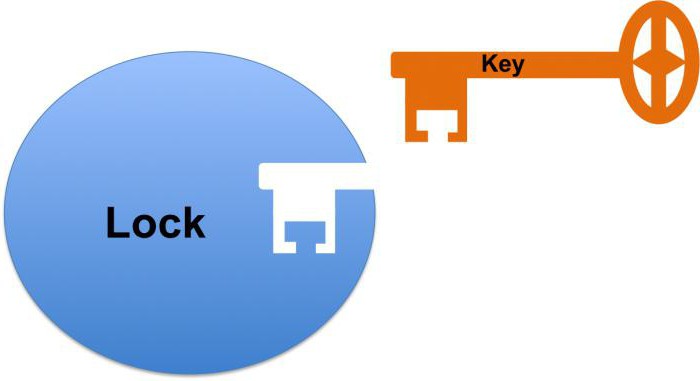
1) Каталитический центр – это специальная область белка, по которой происходит присоединение фермента к субстрату. В зависимости от конформации белковой молекулы каталитический центр может принимать разнообразную форму, которая должна соответствовать субстрату так же, как замок ключу. Такая сложная структура объясняет то, что ферментативный белок находится в третичном или четвертичном состоянии.
2) Адсорбционный центр – выполняет роль «держателя». Здесь в первую очередь происходит связь между молекулой фермента и молекулой-субстратом. Однако связи, которые образует адсорбционный центр, очень слабые, а значит, каталитическая реакция на этом этапе обратима.
3) Аллостерические центры могут располагаться как в активном центре, так и по всей поверхности фермента в целом. Их функция – регулирование работы энзима. Регулирование происходит с помощью молекул-ингибиторов и молекул-активаторов.
Активаторные белки, связываясь с молекулой фермента, ускоряют его работу. Ингибиторы же, напротив, затормаживают каталитическую активность, причем это может происходить двумя способами: либо молекула связывается с аллостерическим центром в области активного центра фермента (конкурентное ингибирование), либо она присоединяется к другой области белка (неконкурентное ингибирование). Конкурентное ингибирование считается более действенным. Ведь при этом закрывается место для связывания субстрата с ферментом, причем этот процесс возможен только в случае практически полного совпадения формы молекулы ингибитора и активного центра.
Энзим зачастую состоит не только из аминокислот, но и из других органических и неорганических веществ. Соответственно, выделяют апофермент – белковую часть, кофермент – органическую часть, и кофактор – неорганическую часть. Кофермент может быть представлен улгеводами, жирами, нуклеиновыми кислотами, витаминами. В свою очередь, кофактор – это чаще всего вспомогательные ионы металлов. Активность ферментов определяется его строением: дополнительные вещества, входящие в состав, меняют каталитические свойства. Разнообразные виды ферментов – это результат комбинирования всех перечисленных факторов образования комплекса.
Причины интенсивного развития биохимии и дочерних наук
В 1958 г. Корана открыл ген и его структуру, после чего в 1961 г. был расшифрован генетический код. Затем было установлено строение молекулы ДНК — двухцепочечная структура, способная к редупликации (самовоспроизведению). Были описаны все тонкости процессов метаболизма (анаболизм и катаболизм), изучена третичная и четвертичная структура белковой молекулы. И это далеко не полный список грандиозных по значимости открытий XX века, которые и составляют основу биохимии. Все эти открытия принадлежат биохимикам и самой науке как таковой. Поэтому предпосылок для ее развития множество. Можно выделить несколько современных причин ее динамичности и интенсивности в становлении.
- Выявлены основы большинства химических процессов, происходящих в живых организмах.
- Сформулирован принцип единства в большинстве физиологических и энергетических процессов для всех живых существ (например, они одинаковы у бактерий и человека).
- Медицинская биохимия позволяет получить ключ к лечению массы различных сложных и опасных заболеваний.
- При помощи биохимии стало возможным подобраться к решению самых глобальных вопросов биологии и медицины.

Отсюда вывод: биохимия — это прогрессивная, важная и очень широко спектральная наука, позволяющая найти ответы на многие вопросы человечества.
Архивы
АрхивыВыберите месяц Август 2020 (4) Июль 2020 (5) Май 2020 (3) Апрель 2020 (5) Март 2020 (2) Февраль 2020 (4) Январь 2020 (4) Декабрь 2019 (1) Ноябрь 2019 (3) Октябрь 2019 (6) Сентябрь 2019 (6) Август 2019 (4) Июль 2019 (7) Июнь 2019 (10) Май 2019 (6) Апрель 2019 (8) Март 2019 (9) Февраль 2019 (5) Январь 2019 (10) Декабрь 2018 (9) Ноябрь 2018 (2) Октябрь 2018 (22) Сентябрь 2018 (14) Август 2018 (12) Июль 2018 (12) Июнь 2018 (11) Май 2018 (9) Апрель 2018 (12) Март 2018 (13) Февраль 2018 (11) Январь 2018 (12) Декабрь 2017 (11) Ноябрь 2017 (10) Октябрь 2017 (12) Сентябрь 2017 (8) Август 2017 (10) Июль 2017 (8) Июнь 2017 (7) Май 2017 (7) Апрель 2017 (5) Март 2017 (5) Февраль 2017 (7) Январь 2017 (2) Декабрь 2016 (11) Ноябрь 2016 (9) Октябрь 2016 (2) Сентябрь 2016 (1) Август 2016 (6) Июль 2016 (8) Июнь 2016 (9) Май 2016 (19) Апрель 2016 (15) Март 2016 (17) Февраль 2016 (31) Январь 2016 (36) Декабрь 2015 (36) Ноябрь 2015 (21) Октябрь 2015 (47) Сентябрь 2015 (29) Август 2015 (40) Июль 2015 (34) Июнь 2015 (43) Май 2015 (54) Апрель 2015 (61) Март 2015 (81) Февраль 2015 (57) Январь 2015 (83) Декабрь 2014 (102) Ноябрь 2014 (97) Октябрь 2014 (49) Сентябрь 2014 (59) Август 2014 (72) Июль 2014 (81) Июнь 2014 (27) Май 2014 (27) Апрель 2014 (27) Март 2014 (37) Февраль 2014 (47) Январь 2014 (43) Декабрь 2013 (45) Ноябрь 2013 (31) Октябрь 2013 (44) Сентябрь 2013 (13) Август 2013 (43) Июль 2013 (41) Июнь 2013 (73) Май 2013 (58) Апрель 2013 (64) Март 2013 (63) Февраль 2013 (39) Январь 2013 (37) Декабрь 2012 (28) Ноябрь 2012 (32) Октябрь 2012 (59) Сентябрь 2012 (45) Август 2012 (58) Июль 2012 (44) Июнь 2012 (19) Май 2012 (22) Апрель 2012 (28) Март 2012 (38) Февраль 2012 (22) Январь 2012 (26) Декабрь 2011 (28) Ноябрь 2011 (22) Октябрь 2011 (23) Сентябрь 2011 (3) Август 2011 (29) Май 2011 (1) Март 2011 (8) Февраль 2011 (6) Январь 2011 (4) Декабрь 2010 (6) Ноябрь 2010 (9) Октябрь 2010 (13)
Особенности метаболизма по ГН
Однако даже продукты с высоким гликемическим индексом не способны нарушить обмен и функции углеводов так, как это делает гликемическая нагрузка. Она определяет, насколько сильно печень загрузится глюкозой при употреблении этого продукта. При достижении определенного порога ГН (порядка 80-100), все калории, поступающие сверх нормы, будут автоматически конвертироваться в триглицериды.
Примерная таблица гликемической нагрузки с общей калорийностью:
| Наименование | ГН | Калорийность |
| Семечки подсолнуха сухие | 2.5 | 520 |
| Арахис | 2.0 | 552 |
| Брокколи | 0.2 | 24 |
| Грибы | 0.2 | 24 |
| Салат листовой | 0.2 | 26 |
| Салат-латук | 0.2 | 22 |
| Помидоры | 0.4 | 24 |
| Баклажаны | 0.5 | 24 |
| Зеленый перец | 0.5 | 25 |
Экстремофилы и промышленность
Живые организмы, а также ферменты, позволяющие им функционировать, были найдены в гейзерах, где температура близка к точке кипения, и глубоко во льдах, а также в условиях крайней солености (Долина Смерти в США). Кроме того, ученые находили энзимы, для которых уровень рН, как оказалось, также не принципиальное требование для эффективной работы. Исследователи с особым интересом изучают ферменты-экстремофилы, как вещества, которые могут быть широко использованы в промышленности. Хотя и сегодня энзимы уже нашли свое применение в индустрии как биологически и экологически чистые вещества. К применению энзимов прибегают в пищевой промышленности, косметологии, производстве бытовой химии.
Более того, «услуги» ферментов в таких случаях обходятся дешевле, чем синтетических аналогов. Кроме того, натуральные вещества являются биоразлагаемыми, что делает их использование безопасным для экологии. В природе существуют микроорганизмы, способные расщепить ферменты на отдельные аминокислоты, которые затем становятся компонентами новой биологической цепочки. Но это, как говорится, уже совсем другая история.
- Источники
- Коровкин Б. Ф. – Ферменты в жизни человека / Б. Ф. Коровкин. – М.: Медицина, 2016 г. – 770 c.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Автор статьи:
Извозчикова Нина Владиславовна
Специальность: инфекционист, гастроэнтеролог, пульмонолог.
Общий стаж: 35 лет.
Образование: 1975-1982, 1ММИ, сан-гиг, высшая квалификация, врач-инфекционист.
Ученая степень: врач высшей категории, кандидат медицинских наук.
Повышение квалификации:
- Инфекционные болезни.
- Паразитарные заболевания.
- Неотложные состояния.
- ВИЧ.
Другие статьи автора
Будем признательны, если воспользуетесь кнопочками:
Классификация ферментов
В организме человека можно найти огромное количество ферментов. Все знания об их функциях и работе были систематизированы, и в итоге появилась единая классификация, благодаря которой можно легко определить, для чего предназначен тот или иной катализатор. Здесь представлены 6 основных классов энзимов, а также примеры некоторых подгрупп.
- Оксидоредуктазы.
Ферменты этого класса катализируют окислительно-восстановительные реакции. Всего выделяют 17 подгрупп. Оксидоредуктазы обычно имеют небелковую часть, представленную витамином или гемом.
Среди оксидоредуктаз часто встречаются следующие подгруппы:
а) Дегидрогеназы. Биохимия ферментов-дегидрогеназ заключается в отщеплении атомов водорода и переносе их на другой субстрат. Эта подгруппа чаще всего встречается в реакциях дыхания, фотосинтеза. В составе дегидрогеназ обязательно присутствует кофермент в виде НАД/НАДФ или флавопротеидов ФАД/ФМН. Нередко встречаются ионы металлов. Примерами могут служить такие энзимы, как цитохромредуктазы, пируватдегидрогеназа, изоцитратдегидрогеназа, а также многие ферменты печени (лактатдегидрогеназа, глутаматдегидрогеназа и т. д.).
б) Оксидазы. Ряд ферментов катализирует присоединение кислорода к водороду, в результате чего продуктами реакции могут быть вода или пероксид водорода (H20, H202). Примеры ферментов: цитохромоксидаза, тирозиназа.
в) Пероксидазы и каталазы – энзимы, катализирующие распад H2O2 на кислород и воду.
г) Оксигеназы. Эти биокатализаторы ускоряют присоединение кислорода к субстрату. Дофамингидроксилаза – один из примеров таких энзимов.
2. Трансферазы.
Задача ферментов этой группы состоит в переносе радикалов от вещества-донора к веществу-реципиенту.
а) Метилтрансферазы. ДНК-метилтрансферазы – основные ферменты, контролирующие процесс репликации ДНК. Метилирование нуклеотидов играет большую роль в регуляции работы нуклеиновой кислоты.
б) Ацилтрансферазы. Энзимы этой подгруппы транспортируют ацильную группу с одной молекулы на другую. Примеры ацилтрансфераз: лецитинхолестеринацилтрансфераза (переносит функциональную группу с жирной кислоты на холестерин), лизофосфатидилхолинацилтрансфераза (ацильная группа переносится на лизофосфатидилхолин).
в) Аминотрансферазы – ферменты, которые участвуют в превращении аминокислот. Примеры ферментов: аланинаминотрансфераза, которая катализирует синтез аланина из пирувата и глутамата путем переноса аминогруппы.
г) Фосфотрансферазы. Ферменты этой подгруппы катализируют присоединение фосфатной группы. Другое название фосфотрансфераз, киназы, встречается намного чаще. Примерами могут служить такие энзимы, как гексокиназы и аспартаткиназы, которые присоединяют фосфорные остатки к гексозам (чаще всего к глюкозе) и к аспарагиновой кислоте соответственно.
3. Гидролазы – класс энзимов, которые катализируют расщепление связей в молекуле с последующим присоединением воды. Вещества, которые относятся к этой группе, — основные ферменты пищеварения.
а) Эстеразы – разрывают эфирные связи. Пример – липазы, которые расщепляют жиры.
б) Гликозидазы. Биохимия ферментов этого ряда заключается в разрушении гликозидных связей полимеров (полисахаридов и олигосахаридов). Примеры: амилаза, сахараза, мальтаза.
в) Пептидазы – энзимы, катализирующие разрушение белков до аминокислот. К пептидазам относятся такие ферменты, как пепсины, трипсин, химотрипсин, карбоиксипептидаза.
г) Амидазы – расщепляют амидные связи. Примеры: аргиназа, уреаза, глутаминаза и т. д. Многие ферменты-амидазы встречаются в орнитиновом цикле.
4. Лиазы – ферменты, по функции схожие с гидролазами, однако при расщеплении связей в молекулах не затрачивается вода. Энзимы этого класса всегда имеют в составе небелковую часть, например, в виде витаминов В1 или В6.
а) Декарбоксилазы. Эти ферменты действуют на С-С связь. Примерами могут служить глутаматдекарбоксилаза или пируватдекарбоксилаза.
б) Гидратазы и дегидратазы – ферменты, которые катализируют реакцию расщепления связей С-О.
в) Амидин-лиазы – разрушают С-N связи. Пример: аргининсукцинатлиаза.
г) Р-О лиазы. Такие ферменты, как правило, отщепляют фосфатную группу от вещества-субстрата. Пример: аденилатциклаза.
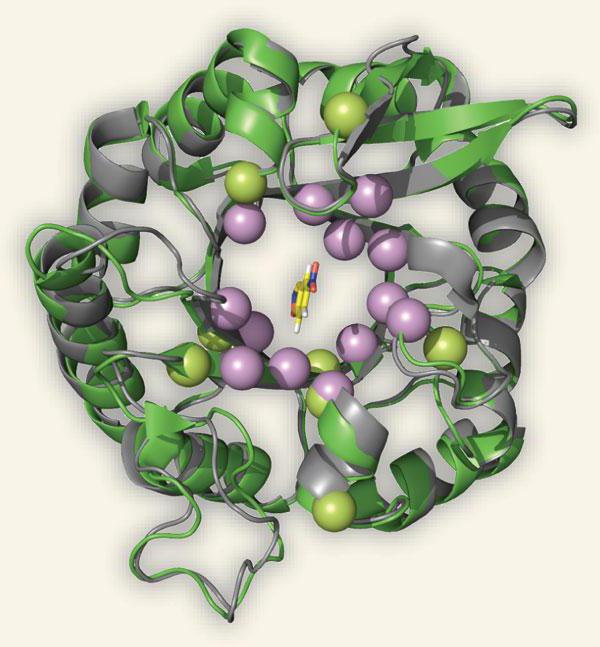
Энзимопатология
В медицине есть целый раздел, который занимается поиском связи между заболеванием и отсутствием синтеза определенного фермента. Это область энзимологии – энзимопатология. Недостаточный синтез ферментов также подлежит рассмотрению. Например, наследственное заболевание фенилкетонурия развивается на фоне потери способности клеток печени осуществлять синтез этого вещества, что катализирует превращение в тирозин фенилаланина. Симптомами данного заболевания являются расстройства психической деятельности. Из-за постепенного накопления токсических веществ в организме больного тревожат такие признаки, как рвота, беспокойство, повышенная раздражительность, отсутствие интереса к чему-либо, выраженная усталость.
При рождении ребенка патология не проявляется. Первичную симптоматику можно заметить в возрасте от двух до шести месяцев. Второе полугодие жизни малыша характеризируется выраженным отставанием в психическом развитии. У 60% больных развивается идиотия, менее чем 10% ограничиваются слабой степенью олигофрении. Ферменты клетки не справляются со своими функциями, но это можно поправить. Своевременная диагностика патологических изменений способна приостановить развитие заболевание до периода полового созревания. Лечение заключается в ограничении поступления с пищей фенилаланина.
Активность ферментов
Для того чтобы данные вещества полностью выполняли свои функции, необходимы определенные условия. На их активность влияет в первую очередь температура. При повышенной возрастает скорость химических реакций. В результате увеличения скорости молекул у них появляется больше шансов на столкновение друг с другом, и возможность протекания реакции, следовательно, увеличивается. Оптимальная температура обеспечивает наибольшую активность. Вследствие денатурации белков, которая происходит при отклонении оптимальной температуры от нормы, снижается скорость химической реакции. При достижении температуры точки замерзания фермент не денатурирует, но инактивируется. Способ быстрого замораживания, который широко используют для длительного хранения продуктов, останавливает рост и развитие микроорганизмов с последующей инактивацией ферментов, которые находятся внутри. Как результат, продукты питания не разлагаются.
На активность ферментов также влияет кислотность окружающей среды. Работают они при нейтральном рН. Только некоторые из ферментов работают в щелочной, сильнощелочной, кислой или сильнокислой среде. Например, сычужный фермент расщепляет белки в сильнокислой среде в желудке человека. На фермент могут действовать ингибиторы и активаторы. Активируют их некоторые ионы, например, металлов. Другие ионы оказывают подавляющее действие на активность ферментов.
Биохимическая реакция
Биохимические реакции при наличии разлагающих углеводороды бактерий могут привести к уничтожению скоплений нефти и газа. Химические процессы могут не только разрушить нефть, но л уменьшить воздействие физических процессов разрушения, когда окисленная нефть создает асфальтовые пробки, которые сдерживают последующие порции поступающей нефти от рассеивания.
Биохимические реакции катализируются большими молекулами белков, называемых ферментами. В результате превращений, которые в лаборатории требуют высоких температур, длительного времени реакции или экстремальных значений рН, происходят в условиях живого организма и при этом быстро.
Биохимические реакции, в результате которых простые предшественники превращаются в тетрапирролы, оставались совершенно неизвестными до тех пор, пока для их изучения не стали применять изотопные методы.
Биохимические реакции при наличии разлагающих углеводороды бактерий могут привести к уничтожению скоплений нефти и газа. Химические процессы могут не только разрушить нефть, но и уменьшить воздействие физических процессов разрушения, когда окисленная нефть создает асфальтовые пробки, которые сдерживают последующие порции поступающей нефти от рассеивания.
Биохимические реакции, лежащие в основе обмена веществ и жизнедеятельности организмов, полностью подчиняются законам химии и физики.
Биохимические реакции, в которых участвует витамин Bi2, изучены крайне недостаточно. Имеющиеся данные указывают на его участие в качестве коэнзима в энзи-матической системе, синтезирующей тимип ( 5-метилурацил ( XII) и другие пурин-вые и пиримидиновые основания, образующиеся в недостаточном количестве при заболевании злокачественной ( пернициозной) анемией. Установлено, что введение тимииа ( и некоторых Других пиримидпновых и пуриповых оснований) больным злокачественной анемией оказывает лечебный эффект.
Биохимические реакции у растений и животных ускоряются биологическими катализаторами, называемыми фермент а-м и. Они представляют собой либо высокомолекулярные белки, либо сочетание белков с соединениями небелковой природы. Каждый фермент характеризуется высокой избирательностью по отношению в каждому конкретному процессу. Например, окисление сахара в организме протекает примерно в 106 раз быстрее, чем при той же температуре в водном растворе под влиянием кислорода. В сложной цепи биохимических процессов окисления сахара в организме участвует несколько ферментов, каждый из которых катализирует отдельную стадию.
Биохимические реакции у растений и животных ускоряются биологическими катализаторами, называемыми ферментами. Они представляют собой либо высокомолекулярные белки, либо сочетание белков с соединениями небелковой природы. Каждый фермент характеризуется высокой избирательностью по отношению к каждому конкретному процессу. Например, окисление сахара в организме протекает примерно в 106 раз быстрее, чем при той же температуре в водном растворе под влиянием кислорода.
Биохимические реакции в организме в большинстве случаев являются многоступенчатыми, последовательными. Процессы, протекающие в организме, принято характеризовать стационарными концентрациями веществ. В состоянии равновесия концентрации веществ, участвующих в реакции, поддерживаются за счет восполнения исходных и удаления конечных продуктов. Изменение концентрации реагирующих веществ не приводит в отличие от закрытых систем к новому термодинамическому равновесию. В силу указанных причин система возвращается в первоначальное стационарное состояние.
Некоторые биохимические реакции ускоряются под влиянием солнечной радиации.
Эта биохимическая реакция является источником энергии, необходимой организму для его жизнедеятельности. При окислении глюкозы до пировиноградной кислоты часть выделяющейся при этом энергии аккумулируется в виде макроэргических связей АТФ. При ферментативном превращении АТФ в АДФ эта энергия выделяется вновь и используется организмом.
Эта биохимическая реакция является формально гидролизом, но ее действительный механизм ( по-видимому, окисление) безусловно, более сложен.
Все биохимические реакции, с которыми мы познакомились, протекают при обычных температурах и давлениях. Многие биохимические реакции ( особенно в организме человека) происходят при 37 С с достаточной скоростью, обеспечивающей жизнь, развитие и воспроизводство.
Каждая биохимическая реакция протекает с непременным участием определенного фермента.
Многие биохимические реакции в организме протекают по механизму сопряженных химических реакций.
Функции энзимов в клетке
Главная задача фермента – ускорение соответствующей реакции. Любой каскад процессов, начиная с разложения пероксида водорода и заканчивая гликолизом, требует присутствия биологического катализатора.
Правильная работа ферментов достигается высокой специфичностью к определенному субстрату. Это значит, что катализатор может ускорять только определенную реакцию и никакую больше, даже очень похожую. По степени специфичности выделяют следующие группы энзимов:
1) Ферменты с абсолютной специфичностью, когда катализируется только одна-единственная реакция. Например, коллагеназа расщепляет коллаген, а мальтаза расщепляет мальтозу.
2) Ферменты с относительной специфичностью. Сюда входят такие вещества, которые могут катализировать определенный класс реакций, к примеру, гидролитическое расщепление.
Работа биокатализатора начинается с момента присоединения его активного центра к субстрату. При этом говорят о комплементарном взаимодействии наподобие замка и ключа. Здесь имеется в виду полное совпадение формы активного центра с субстратом, что дает возможность ускорять реакцию.
Следующий этап заключается в протекании самой реакции. Ее скорость возрастает благодаря действию ферментативного комплекса. В конечном итоге мы получаем энзим, который связан с продуктами реакции.
Заключительный этап – отсоединение продуктов реакции от фермента, после чего активный центр вновь становится свободным для очередной работы.
Схематично работу фермента на каждом этапе можно записать так:
1) S + E ——> SE
2) SE ——> SP
3) SP ——> S + P , где S – это субстрат, E – фермент, а P – продукт.
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Современные разделы биохимии
На современном этапе развития биохимия включает в себя несколько основных разделов, которые представлены в таблице.
|
Раздел |
Определение |
Объект изучения |
|
Динамическая биохимия |
Изучает химические реакции, лежащие в основе взаимопревращения молекул внутри организма |
Метаболиты — простые молекулы и их производные, образующиеся в результате обмена энергии; моносахариды, жирные кислоты, нуклеотиды, аминокислоты |
|
Статическая биохимия |
Изучает химический состав внутри организмов и структуру молекул |
Витамины, белки, углеводы, нуклеиновые кислоты, аминокислоты, нуклеотиды, липиды, гормоны |
|
Биоэнергетика |
Занимается изучением поглощения, накопления и преобразования энергии в живых биологических системах |
Один из разделов динамической биохимии |
|
Функциональная биохимия |
Изучает подробности всех физиологических процессов организма |
Питание и пищеварение, дыхание, регуляция кислотно-щелочного баланса, мышечные сокращения, проведение нервного импульса, регуляция печени и почек, действие иммунной и лимфатической систем и так далее |
|
Медицинская биохимия (биохимия человека) |
Изучает процессы метаболизма в организме людей (в здоровых организмах и при заболеваниях) |
Эксперименты на животных позволяют вывести чистые культуры патогенных бактерий, вызывающих заболевания у людей, и найти способы борьбы с ними |
Таким образом, можно сказать, что биохимия — это целый комплекс маленьких наук, которые охватывают все многообразие сложнейших внутренних процессов живых систем.
Этапы расщепления сахаридов
Прежде чем рассматривать особенности биохимических реакций в организме и влияние метаболизма углеводов на спортивные результаты, изучим процесс расщепления сахаридов с их дальнейшим превращением в тот самый гликоген, который так отчаянно добывают и тратят спортсмены во время подготовки к соревнованиям.

Этап 1 – предварительное расщепление слюной
В отличие от белков и жиров, углеводы начинают распадаться почти сразу после попадания в полость рта. Дело в том, что большая часть продуктов, поступающих в организм, имеет в своем составе сложные крахмалистые углеводы, которые под воздействием слюны, а именно фермента амилазы, входящей в ее состав, и механического фактора расщепляются на простейшие сахариды.
Этап 2 – влияние желудочной кислоты на дальнейшее расщепление
Здесь вступает в силу желудочная кислота. Она расщепляет сложные сахариды, которые не попали под воздействие слюны. В частности, под действием ферментов лактоза расщепляется до галактозы, которая в последствии превращается в глюкозу.
Этап 3 – всасывание глюкозы в кровь
На этом этапе практически вся ферментированная быстрая глюкоза напрямую всасывается в кровь, минуя процессы ферментации в печени. Уровень энергии резко повышается, а кровь становится более насыщенной.
Этап 4 – насыщение и инсулиновая реакция
Под воздействием глюкозы кровь густеет, что затрудняет её перемещение и транспортировку кислорода. Глюкоза замещает кислород, что вызывает предохранительную реакцию – уменьшение количества углеводов в крови.
Первый открывает транспортные клетки для перемещения в них сахара, что восстанавливает утраченный баланс веществ. Глюкагон в свою очередь уменьшает синтез глюкозы из гликогена (потребление внутренних источников энергии), а инсулин “дырявит” основные клетки организма и помещает туда глюкозу в виде гликогена или липидов.
Этап 5 – метаболизм углеводов в печени
На пути к полному перевариванию углеводы сталкиваются с главным защитником организма – клетками печени. Именно в этих клетках углеводы под воздействием специальных кислот связываются в простейшие цепочки – гликоген.
Этап 6 – гликоген или жир
Печень способна переработать только определенное количество моносахаридов, находящихся в крови. Возрастающий уровень инсулина заставляет её делать это в кратчайшие сроки. В случае, если печень не успевает перевести глюкозу в гликоген, наступает липидная реакция: вся свободная глюкоза путём её связывания кислотами превращается в простые жиры. Организм делает это с целью оставить запас, однако в виду нашего постоянного питания, “забывает” переварить, и глюкозные цепочки, превращаясь в пластические жировые ткани, транспортируются под кожу.
Этап 7 – вторичное расщепление
В случае, если печень справилась с сахарной нагрузкой и смогла превратить все углеводы в гликоген, последний под воздействием гормона инсулина успевает запастись в мышцах. Далее в условиях недостатка кислорода расщепляется назад до простейшей глюкозы, не возвращаясь в общий кровоток, а сохраняясь в мышцах. Таким образом, минуя печень, гликоген поставляет энергию для конкретных мышечных сокращений, повышая при этом выносливость (источник – “Википедия”).
Значение
Если говорить о том, что такое ферменты, нельзя обойти стороной вопрос об их значении в современном мире. Они нашли широкое применение почти во всех отраслях деятельности человека. Такая их распространенность связана с тем, что они способны вне живых клеток сохранять свои уникальные свойства. В медицине, например, применяются ферменты групп липаз, протеаз, амилаз. Они расщепляют жиры, белки, крахмал. Как правило, этот тип входит в состав таких лекарственных препаратов, как «Панзинорм», «Фестал». Эти средства в первую очередь используются с целью лечения заболеваний ЖКТ. Некоторые ферменты способны растворять в кровеносных сосудах тромбы, они помогают при лечении гнойных ран. В лечении онкологических заболеваний энзимотерапия занимает особое место.
Благодаря способности расщеплять крахмал в пищевой промышленности широко используется фермент амилаза. В этой же области применяют липазы, которые расщепляют жиры и протеазы, расщепляющие белки. В пивоварении, виноделии и хлебопечении используют ферменты амилазы. В приготовлении готовых каш и для смягчения мяса применяют протеазы. В производстве сыра используют липазы и сычужный фермент. В косметической промышленности также не обойтись без них. Они входят в состав стиральных порошков, кремов. В стиральные порошки, например, добавляют расщепляющую крахмал амилазу. Белковые загрязнения и белки расщепляются протеазами, а липазы очищают ткань от масла и жира.
Роль ферментов в организме
Два процесса отвечают в организме человека за обмен веществ: анаболизм и катаболизм. Первый обеспечивает усвоение энергии и необходимых веществ, второй – распад продуктов жизнедеятельности. Постоянное взаимодействие этих процессов влияет на усвоение углеводов, белков и жиров и поддержание жизнедеятельности организма. Обменные процессы регулируются тремя системами: нервной, эндокринной и кровеносной. Они могут нормально функционировать с помощью цепи ферментов, которые в свою очередь обеспечивают адаптацию человека к изменениям условий внешней и внутренней среды. В состав ферментов входит как белковая, так и небелковая продукция.
В процессе биохимических реакций в организме, в протекании которых принимают участие ферменты, сами они не расходуются. У каждого из них своя химическая структура и своя уникальная роль, поэтому каждый инициирует только определенную реакцию. Биохимические катализаторы помогают прямой кишке, легким, почкам, печени выводить токсины и продукты жизнедеятельности из организма. Также они способствуют построению кожи, костей, нервных клеток, мышечных тканей. Специфические ферменты используются для окисления глюкозы.
Все ферменты в организме делятся на метаболические и пищеварительные. Метаболические участвуют в нейтрализации токсинов, производстве белков и энергии, ускоряют в клетках биохимические процессы. Так, например, супероксидисмутаза является сильнейшим антиоксидантом, который содержится в естественном виде в большинстве зеленых растений, белокочанной, брюссельской капусте и брокколи, в проростках пшеницы, зелени, ячмене.