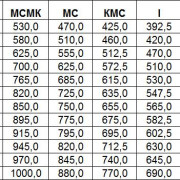
Дистиллированная вода или электролит
Содержание:
Когда употреблять питьевые электролиты?
Питьевые электролиты иногда считают элементом только спортивного питания. Это логично объясняется интенсивной потерей солей при выделении пота во время интенсивных физических нагрузок. Солевые составы востребованы и необходимы во врачебной практике. Аптечный препарат регидрон, представляющий собой растворимую сухую смесь солей, назначают при диарее
На этот факт обратите внимание. Во время такого заболевания организм теряет соли вместе с выделяющейся жидкостью, но не может восполнить дефицит с помощью натуральных пищевых продуктов из-за назначенной диеты
Здоровый человек получает минеральные вещества с едой. Если занятия спортом ведутся на серьезном уровне, и рацион выбирается продуманно, соли поступают в достаточном количестве. Это не исключает вероятность резкого изменения концентрации электролитов, негативно сказывающегося на состоянии спортсмена. Необходимость употребления и дозировку питьевого электролита определяют с учетом интенсивности потери солей и состава напитка. Главный принцип – восполнять то, что потеряно.
Когда употреблять питьевые электролиты?
Знак анода:
В литературе встречается различное обозначение знака анода: «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод – тот, где протекает окисление. При работе электролизера (например, при рафинировании меди, никеля, цинка) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод (т.е. имеет знак «−»). На другом электроде обеспечивается недостаток электронов (положительный заряд) и окисление металла, это анод (т.е. имеет знак «+»).
Наоборот, при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод (знак «−»). Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод (знак «+»).
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора.
Гальванический элемент – это химический источник тока, состоящий из электродов и электролита, заключенных в один сосуд, предназначенный для разового или многократного разряда. Гальваническая батарея, в свою очередь, – это химический источник тока, состоящий из двух или более гальванических элементов, соединенных между собой электрически для совместного производства электрической энергии.
Аккумулятор – это гальванический элемент, предназначенный для многократного разряда за счет восстановления емкости путем заряда электрическим током. Аккумуляторная батарея, в свою очередь, это электрически соединенные между собой аккумуляторы, оснащенные выводами и заключенные, как правило, в одном корпусе
В соответствии с ГОСТ 15596-82 «Источники тока химические. Термины и определения (с Изменением № 1)» отрицательный электрод химического источника тока – это электрод, который при разряде химического источника тока является анодом (знак «−»); положительный электрод химического источника тока – это, который при разряде химического источника тока является катодом (знак «+»). Химический источник тока – это устройство, в котором химическая энергия заложенных в нем активных веществ непосредственно преобразуется в электрическую энергию при протекании электрохимических реакций.
В электротехнике катод – это отрицательный электрод (знак «−»), а анод – положительный электрод (знак «+»). В электротехнике за направление электрического тока принято считать направление движения положительных зарядов. Электрический ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» к «+».
Примечание: Фото //www.pexels.com, //pixabay.com
Коэффициент востребованности 1
Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
Схема электролиза воды:
- анод:
2H2O → O2 + 4H+ + 4e–; - катод:
4H+ + 4e– → 2H2.
Или:
- анод:
3H2O → O3 + 6e– + 6H+; -
катод:
O2 + 2H2O + 2e– → H2O2 + 2OH–.
Общее уравнение:
2H2O → 2H2 + O2.
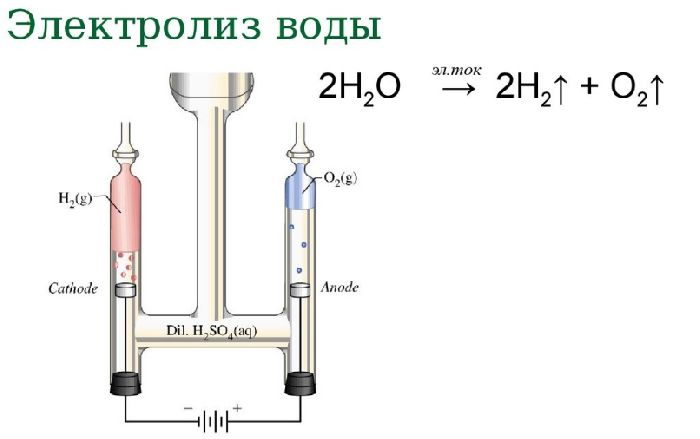
Рис. 2. Схема электролиза воды.
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H+). В противном случае водород не будет произведён. Чтобы исключить конкуренцию, необходимо подобрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H+ воды. На роль катиона электролита подходят:
- Li+;
- Rb+;
- K+;
- Cs+;
- Ba2+;
- Sr2+;
- Ca2+;
- Na+;
- Mg2+.
Для исключения конкуренции анионов, наоборот, подбирают электролит с анионами большего электродного потенциала, чем анион OH– воды. В качестве такого электролита применяется щелочь для образования гидроксильного иона OH–.
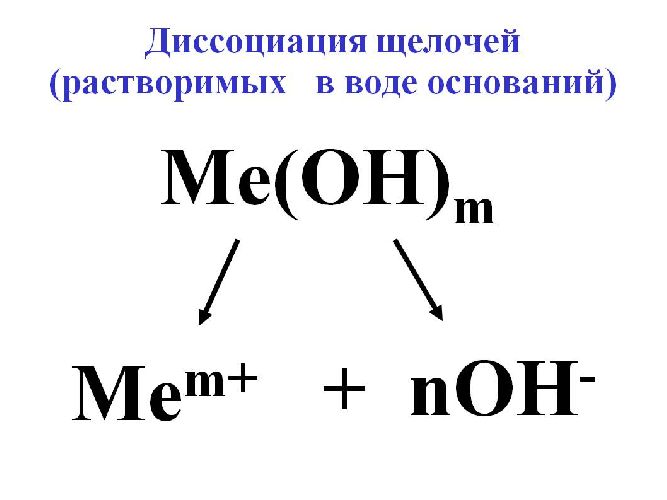
Рис. 3. Диссоциация щёлочи.
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Тест по теме
-
Вопрос 1 из 5
К какому электроду движутся катионы?
- К аноду – положительно заряженному электроду
- К аноду – отрицательно заряженному электроду
- К катоду – положительно заряженному электроду
- К катоду – отрицательно заряженному электроду
Начать тест(новая вкладка)
Как опознать дефицит электролитов?
Вот самые распространенные электролитические катастрофы:
Обезвоживание. Электролиты делают свое дело, когда растворяются в воде, и если вы не заливаете достаточно жидкости в свою систему, то ждите проблем.
Понос и запор. Это важно: кал тоже в большой степени состоит из воды, так что диарея и констипация связаны с дисбалансом электролитов. Если эти радости не проходят за несколько дней, ползите к врачу
Усталость. Самый частый симптом электролитических расстройств. Например, слабость может быть признаком дефицита магния. Он участвует во многих процессах организма, так что нехватка приводит к хронической усталости.
Мышечные спазмы. Если судороги стали слишком частыми и болезненными, это говорит об электролитном дисбалансе/обезвоживании.
Как видите, все эти проблемы связаны с нехваткой электролитов, но и бывают и более редкие из-за чрезмерного количества. Так как ионы имеют разные заряды (положительный и отрицательный), недостаток одних и избыток других в нашем растворе тоже приводит к проблемам.

Симптомы
Организм реагирует на дисбаланс электролитов различными способами. Эффекты могут зависеть от того, какие уровни электролитов несбалансированы, насколько серьезна проблема, и есть ли у человека другие заболевания.
В одном исследовании были изучены данные 996 пациентов, которым была оказана неотложная медицинская помощь по поводу электролитного дисбаланса ().
Исследователи сообщают, что наиболее распространенными симптомами были:
- лихорадка
- одышка
- спутанность сознания
- опухание или вздутие живота
- учащенное сердцебиение
- аритмия
Вот другие симптомы, которые могут возникать при электролитном дисбалансе:
- раздражительность
- усталость
- онемение
- покалывание
- мышечная слабость
- подергивания
- спазмы
- быстрые изменения кровяного давления
- припадки
Как определить необходимое количество для АКБ?
Понять, какое количество нужно для пополнения смеси электролитом (при условии, что нужен именно он) или дистиллированной водой (в аналогичном случае) можно следующими способами.
Визуально
На корпус батареи производитель наносит специальные «риски» min – max. Именно по отметкам на АКБ можно ориентироваться сколько требуется (и чего именно) добавить в смесь. Производя заливку, надо следить, чтобы требуемое количество была добавлена выше минимальной отметки, но ниже максимальной.
Если отметок на корпусе нет, то нужно доливать так, чтобы металлические пластины были покрыты на 1-1,5 см.
Инструментально
 Существуют специальные мерные трубочки, с помощью которых можно замерять уровень электролитической смеси.
Существуют специальные мерные трубочки, с помощью которых можно замерять уровень электролитической смеси.
При отсутствии прибора можно использовать любую стеклянную или пластиковую палочку. Подойдет палочка длиной 20-25 см, толщиной 5-7 мм.
Открыв все банки, в каждой по отдельности нужно замерить уровень. Для этого опустить трубочку до упора и поднять ее. На ней четко будет видно, сколько смеси в банке АКБ.
Доливать нужно до того момента, как уровень будет определяться в высоту 1,5-2,0 см. Если дистиллированная вода долита до нужного уровня, плотность электролитической смеси восстановится в первоначальные параметры 1,27 г/см.куб. Это необходимо для обеспечения полноценной работы АКБ.
Внимание! Долив в необслуживаемых аккумуляторах не предусмотрен производителем! Доступ к банкам строго ограничен полной герметизацией корпуса.
В видео подробная информация о том, как измерить уровень электролита в аккумуляторе:
Молоко
Когда дело доходит до электролитных напитков, коровье молоко – это своего рода невоспетый герой. Вопреки распространенному мнению, молоко можно использовать не только для завтрака или кофе.
В дополнение к богатому содержанию электролитов, таких как кальций, натрий и калий, молоко обеспечивает организм человека здоровой комбинацией углеводов и белка. Эти два макроэлемента могут помочь вам восполнить их запасы и способствовать восстановлению мышечной ткани после тренировки.
Некоторые исследования предполагают, что эти характеристики могут сделать молоко лучшим напитком после тренировки, чем многие коммерческие спортивные напитки.
Учитывая, что польза молока зависит от содержащихся в нем электролитов, углеводов и белка, вы можете отдавать предпочтение цельному, низкожирному или обезжиренному молоку, в зависимости от ваших личных предпочтений.
Стоит отметить, что обычное коровье молоко не может быть правильным выбором для всех, особенно для тех, кто придерживается веганской диеты или не переносит молочные продукты.
Если вы не переносите лактозу, но все же хотите включить молоко в свой режим восстановления после тренировки, отдавайте предпочтение варианту без лактозы.
Между тем, если вы придерживаетесь веганской диеты или у вас аллергия на молочный белок, вам следует полностью избегать молока.
Хотя альтернативы растительного происхождения, вероятно, не принесут той же пользы, что и коровье молоко, некоторые исследования показали, что белок в соевом молоке может способствовать восстановлению мышц, в то же время обеспечивая организм электролитами, аналогично коровьему молоку.
Молоко является хорошим источником электролитов, а также белков и углеводов, что делает его хорошим напитком после тренировки.
Лабораторная работа №4.
1. Электролиз водного раствора иодида калия.
2KJ+2H2O электролиз J2+2H2+2KOH
Процесс на аноде.
А(+): 2J—2e-→J2
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
В результате электролиза наблюдаем:
При добавлении фенолфталеина в околокатодное пространство раствор становится малинового цвета, так как при восстановлении молекул воды образуются ионы ОН-, которые создают щелочную среду.
При добавлении раствора крахмала в околоанодное простанство наблюдаем появление синего окрашивания, которое является качественной реакцией на молекулярный йод, который образуется при окислении ионов J-.
2. Электролиз водного раствора сульфата натрия.
- Na2SO4+2H2O электролиз Na2SO4+2H2+O2↑
- 2H2O электролиз 2H2+O2↑
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
При добавлении раствора универсального индикатора в околокатодное пространство наблюдаем синее окрашивание, так как при восстановлении молекул воды образуются ОН- ионы, которые дают щелочную среду.
При добавлении раствора универсального индикатора в околоанодное пространство наблюдаем красное окрашивание, так как при окислении молекул воды образуются H+ ионы, кторые дают кислую среду.
Сульфат натрия не принимает участия в электролизе. Протекает только электролиз воды.
3. Электролиз водного раствора сульфата меди (II).
2CuSO4+2H2Oэлектролиз 2Cu+O2+2H2SO4
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): Cu2++2е-→Сu0
При электролизе раствора сульфата меди (II) на катоде наблюдаем выделение осадка красной меди.
В околоанодном пространстве выделяются пузырьки кислорода.
Вывод по проведенной работе:
Электролиз -окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Электролиз растворов осложняется участием в электродных процессах ионов Н⁺ и ОН⁻. Кроме того, молекулы воды сами могут подвергаться электродному окислению или восстановлению.
Катодные процессы в водных растворах при электролизе зависят от природы катиона.
Процессы, происходящие на катоде зависят от окислительной способности катиона металла:
- Li, K, Ca, Na, Mg, Al Mn, Zn, Fe, Ni, Sn, Pb H Cu, Hg, Ag, Pt, Au
- Меn⁺не восстанавливается (остаётся в растворе)
- 2 Н₂О+ 2ē = Н₂↑+2 ОН⁻ Меn⁺ + nē = Me°
- 2 H₂O + 2ē = H₂↑ + 2 OH⁻ Men⁺ + nē = Me°
Анодные процессы в водных растворах зависят от материала анода и природы аниона.
Процессы, происходящие на аноде
Безкислородные кислотные остатки
Кислородсодержащие кислотные остатки
- J⁻, Br⁻, S²⁻, Cl⁻ Окисление Аm⁻ (кроме F⁻)
- Аm⁻ – m ē = A° OH⁻, SO₄²⁻, NO₃⁻, F⁻
В щелочной среде:
- 4 ОН⁻ – 4 ē = О₂↑ + 2 Н₂О
- в кислой и нейтральной среде: 2 Н₂О – 4 ē = О₂↑ + 4 Н⁺
(Влияние материала анода не рассматриваем, так как в лабораторной работе влияние материала анода на протекание электролиза не рассматривается).
8. Приведите формулировку законов Фарадея? Каковы их математические выражения? Что называют числом Фарадея? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов CdCl2 и CdSO4.
Ответ:
Течение первичных анодных и катодных реакций во время протекания электролиза подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
- m = kQ, но Q =It (1)
- где I – сила тока, А; t – время пропускание тока, с.
- m = kIt (2)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (2), получим формулу, объединяющую оба закона Фарадея.
(3)
Соотношение (3) используют в расчетах процессов при электролизе.
Электролиз водного раствора хлорида кадмия (II):
- CdCl2Cd2++2Cl-
- K(-):Cd2+, H2O А(+): Cl-, H2O
- Cd2++2e-→Cd 2Cl—2e-→Cl2
Суммарное уравнение электролиза:
CdCl2→Сd+Cl2
Электролиз водного раствора сульфата кадмия (II):
- CdSO4→ Cd2++SO42-
- K(-):Cd2+, H2O А(+):SO42-, H2O
- Cd2++2e-→Cd 2H2O-4e-→O2+4H+
Суммарное уравнение электролиза:
2CdSO4+2 H2O→2Cd+O2+2H2SO4
Использование термина
В естественных науках
Термин электролит широко используется в биологии и медицине. Чаще всего подразумевают водный раствор, содержащий те или иные ионы (напр., «всасывание электролитов» в кишечнике).
В технике
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
В электрохимии
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например электролит золочения).
В источниках тока
Электролиты являются важной частью химических источников тока: гальванических элементов и аккумуляторов. Электролит участвует в химических реакциях окисления и восстановления с электродами, благодаря чему возникает ЭДС
В источниках тока электролит может находиться в жидком состоянии (обычно это водный раствор) или загущённым до состояния геля.
Электролитический конденсатор
Основная статья: Электролитический конденсатор
В электролитических конденсаторах в качестве одной из обкладок используется электролит. В качестве второй обкладки — металлическая фольга (алюминий) или пористый, спечённый из металлических порошков блок (тантал, ниобий). Диэлектриком в таких конденсаторах служит слой оксида самого металла, формируемый химическими методами на поверхности металлической обкладки.
Конденсаторы данного типа, в отличие от других типов, обладают несколькими отличительными особенностями:
- высокая объёмная и весовая удельная ёмкость;
- требование к полярности подключения в цепях постоянного напряжения. Несоблюдение полярности вызывает бурное вскипание электролита, приводящее к механическому разрушению корпуса конденсатора (взрыву);
- значительные утечки и зависимость электрической ёмкости от температуры;
- ограниченный сверху диапазон рабочих частот (типовые значения сотни кГц — десятки МГц в зависимости от номинальной ёмкости и технологии).
Активности в электролитах
Химический потенциал для отдельного i-го иона имеет вид: μi=μi+RTlnai,{\displaystyle \mu _{i}=\mu _{i}^{0}+RTlna_{i},} где ai{\displaystyle a_{i}} — активность i-го иона в растворе.
Для электролита в целом имеем:
μel=∑iviμi=v+μM++v−μA−=v+(μ++RTlnaM+)+v−(μ−+RTlnaA−)={\displaystyle \mu _{el}=\sum _{i}v_{i}\mu _{i}=v_{+}\mu _{M^{+}}+v_{-}\mu _{A^{-}}=v_{+}(\mu _{+}^{0}+RTlna_{M^{+}})+v_{-}(\mu _{-}^{0}+RTlna_{A^{-}})=}
=(v+μ++v−μ−)+RTln(aM+v−⋅aA−v−)=μ+RTlna,{\displaystyle =(v_{+}\mu _{+}^{0}+v_{-}\mu _{-}^{0})+RTln(a_{M^{+}}^{v^{-}}\cdot a_{A^{-}}^{v^{-}})=\mu _{0}+RTlna,} где a{\displaystyle a} — активность электролита; vi{\displaystyle v_{i}} — стехиометрические числа.
Таким образом, имеем:
a=a+v+⋅a−v−.{\displaystyle a=a_{+}^{v^{+}}\cdot a_{-}^{v^{-}}.}
Усредненная активность иона равна:
a±=a+v+⋅a−v−1v++v−.{\displaystyle a_{\pm }=\left^{\frac {1}{v_{+}+v_{-}}}.}
Для одно-одновалентного электролита v+=v−=1{\displaystyle v_{+}=v_{-}=1} и a±=a+⋅a−,{\displaystyle a_{\pm }={\sqrt {a_{+}\cdot a_{-}}},} то есть a±{\displaystyle a_{\pm }} является средним геометрическим активностей отдельных ионов.
Для добавления растворов электролитов принято пользоваться моляльной (m) концентрацией (для водных растворов m численно равен молярной (с) концентрации). Значит, ai=γimi,{\displaystyle a_{i}=\gamma _{i}m_{i},} где γi{\displaystyle \gamma _{i}} — коэффициент активности i-го иона.
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы:
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как HCl, HBr, HI, HNO3, H2SO4).
- Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты, такие как HF), основания p-, d- и f-элементов.
Между этими двумя группами чёткой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
1.15. Электрический ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
4
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
| Рисунок 1.15.1.Электролиз водного раствора хлорида меди |
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
Здесь m и q – масса и заряд одного иона, – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m иона данного вещества к его заряду q.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q = ne), то выражение для электрохимического эквивалента k можно записать в виде
Здесь NA – постоянная Авогадро, M = mNA – молярная масса вещества, F = eNA – постоянная Фарадея.
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
Явление электролиза широко применяется в современном промышленном производстве.
Домашние средства
Если человек считает, что он может быть слегка обезвожен, чтобы сбалансировать уровень электролитов он может попробовать напиток для регидратации.
Однако будьте осторожны с использованием спортивных напитков для этой цели. Некоторые эксперты считают, что спортивные напитки содержат слишком много сахара и слишком мало натрия, чтобы исправить дисбаланс ().
Тем не менее некоторые исследования показали, что спортивные напитки и растворы для пероральной регидратации дают сходные результаты у людей, которые тренировались в жаркую погоду ().
Всемирная организация здравоохранения (ВОЗ) рекомендует делать раствор для пероральной регидратации дома, а не покупать готовый напиток ().
Рецепт предусматривает смешивание 1 литра воды с 1 чайной ложкой соли и 2 столовыми ложками сахара. Вы можете использовать этот рецепт вместо купленного в магазине раствора электролитов.
Поскольку электролитный дисбаланс может быть опасным для жизни, не пытайтесь использовать домашние средства, если у вас или вашего близкого человека есть серьезные симптомы или какие-либо сопутствующие заболевания.
Младенцы, маленькие дети и пожилые люди также могут иметь более высокий риск серьезных осложнений. Всегда консультируйтесь с врачом в этих случаях.