Виды дистрофии: классификация, особенности, причины и лечение
Содержание:
- Содержание
- Мышечные дистрофии
- Снятие с петель
- Диспротеинозы в детском возрасте
- Локализация амилоидных масс:
- Процесс проведения спинальной анестезии
- Заболевание и у детей
- Классификация дистрофий
- Развитие патологии
- Исследования и прогресс
- Лечение дистрофии
- Патогенез
- Диагностика
- Виды дистрофии
- Стромально-сосудистые белковые дистрофии
- Мукоидное набухание
- Профилактика
- Паренхиматозные белковые дистрофии (диспротеинозы)
- Что такое дистрофические явления и их виды
Содержание
Мышечные дистрофии
сердечная мышцажелудок, кишечникК видам мышечных дистрофий относятся:
- дистрофия Дюшенна;
- мышечная дистрофия Беккера;
- миотоническая дистрофия.
Мышечная дистрофия Дюшенна
разрушениеК признакам дистрофии Дюшенна относятся:
- неуклюжая походка;
- частые падения;
- трудности при беге, прыжках;
- постоянная слабость;
- мышечные контрактуры (состояние, когда вследствие непроизвольного напряжения мышц ограничены функции работы сустава).
Пресимптоматическая стадия дистрофии Дюшеннаанамнезто есть, если в семье имелись случаи заболевания дистрофией ДюшеннаРанняя стадия дистрофии ДюшеннаПоздняя стадия дистрофии ДюшеннасердцаДиагностика дистрофии Дюшеннапсевдогипертрофияанализе кровиБиопсиядыхательной недостаточностисердечной недостаточности
Дистрофия Беккера
Симптомами дистрофии Беккера являются:
- слабость в мышцах – 100 процентов;
- атрофия мышц таза – 90 процентов;
- псевдогипертрофия икроножных мышц – 80 процентов;
- снижение сухожильных рефлексов – 70 процентов.
для сравнения дистрофия Дюшенна – злокачественной
Снятие с петель
Может пригодиться знание, как снять пластиковое окно с петель, если, например, нужно заменить или отремонтировать створку или убрать ее для демонтажа окна. Для проведения этой процедуры необходимо освободить петли от пластиковых накладок. После этого створку потребуется приоткрыть, чтобы обеспечить удобный доступ к петле. Начинать съем нужно с верхней накладки, потом переходить к нижней.
Верхняя петля разбирается первой. Потребуется вытащить из нее шток при помощи плоскогубцев. После этого наклоните створку на себя, снимите ее с нижней петли.
Диспротеинозы в детском возрасте
-
Наиболее частый
вид – паренхиматозные белковые дистрофии
(печень, почки, миокард).
Преимущественно
связаны с гидратацией
(набуханием). Встречаются
у
-
плодов и новорожденных
при внутриутробной гипоксии, -
асфиксии
новорожденных, -
у детей при острых
инфекционных заболеваниях.
Реже развивается
гиалиново-капельная
дистрофия
в гепатоцитах, нефротелии, кардиомиоцитах,
ганглиозных клетках ЦНС. Это
наблюдается
-
при
нефротическом синдроме, -
вирусных
инфекциях.
-
Мезенхимальные
дистрофии
-
в виде мукоидного
и фибриноидного набухания встечаются
у детей школьного возраста при
ревматических болезнях. -
Системный гиалиноз
сосудов наблюдается даже в раннем
возрасте при диабетической фетопатии,
диабете, периартериите.
-
Приобретенный
синтез аномальных белков (амилоида) у
детей, особенно в раннем возрасте,
практически не встречается.
Паренхиматозные
диспротеинозы
– нарушения обмена цитоплазматических
белков, которые находятся в свободном
или связанном состоянии.
-
Связанные белки
входят в состав липопротеидных комплексов
мембран клетки, -
к свободным
относятся главным образом ферменты.
Локализация амилоидных масс:
Процесс проведения спинальной анестезии
После выполнения всех вышеназванных предписаний врача можно приступать непосредственно к уколу анестетика. Для этого пациенту необходимо обеспечить врачу хороший доступ к позвоночнику, приняв положение лежа на боку, либо сидя, с максимально согнутой спиной.
Далее следует обработка зоны введения анестезии антисептическими препаратами и вводится укол местного обезболивающего из первого шприца. Затем анестезиолог осуществляет ввод анестетика, исходя из правил по технике введения данного наркоза – именно в субарахноидальное пространство.
Стоит обратить внимание, что место проведения пункции обычно располагается между II и III позвонками поясничного отдела позвоночного столба, но допустимым также считается введение анестетика вплоть до V позвонка. Выбор места спинальной анестезии зависит от индивидуального строения позвоночника, наличия ранее перенесенных травм или оперативных вмешательств
Заболевание и у детей
Прогрессирующая мышечная дистрофия у детей развивается по-разному и опасна больше осложнениями, чем первичной атрофией мускулов. Даже небольшая инфекция или респираторная патология может привести к летальному исходу из-за стремительного развития и вовлечения других органов. Заподозрить мышечную дистрофию иногда слишком сложно, родителям следует внимательно относиться к появлению симптомов:
- ребенок пытается подняться на носочки при ходьбе;
- обнаруживается задержка в развитии физическом и интеллектуальном;
- поражение мышечных структур начинается с позвоночника;
- сильно изменяется походка, становится развалистой;
- ребенок испытывает трудности во время бега, подъема по лестнице;
- позвоночник начинает деформироваться, из-за чего ребенок быстро утомляется;
- размер мышечных структур резко увеличивается из-за заполнения жировой прослойкой;
- увеличивается челюсть и промежутки между зубами;
- к 13 годам ребенок теряет способность нормально двигаться;
- развиваются сердечно-сосудистые заболевания.
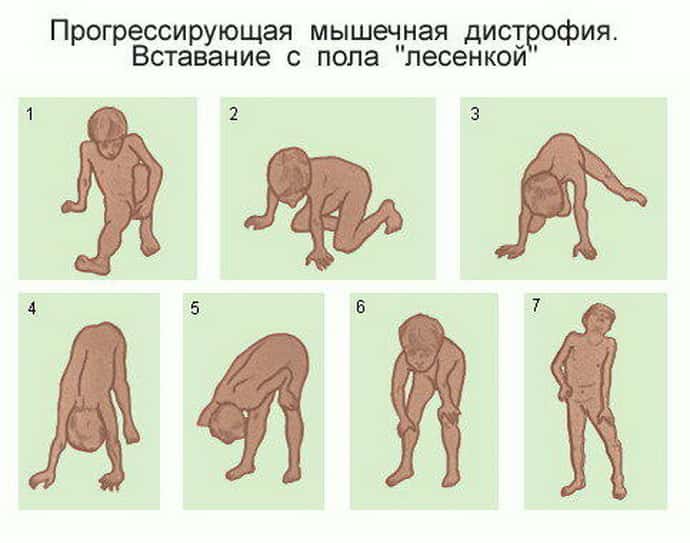
Формы заболевания могут иметь разные названия, но большая часть из них схожа симптомами.
Классификация дистрофий
Выделяют следующие
основные виды дистрофий.
По времени
развития различают
-
наследственные,
-
приобретенные в
пренатальный период (врожденные), -
приобретенные в
различные сроки постнатального периода.
По распространенности
дистрофические процессы
бывают местными и общими, которые могут
быть в объеме:
-
отдельных клеток,
-
клеточных групп
(в рамках структурно-функциональных
единиц органа), -
ткани,
-
органа,
-
многих тканей,
органов, одной или нескольких
физиологических и функциональных
систем организма.
По структурному
уровню дистрофии могут
быть:
-
молекулярными
(биохимический уровень), -
субклеточными
(электронно-микроскопический уровень), -
клеточный
(светооптический уровень), -
сочетанный.
По преобладанию
морфологических изменений в паренхиме
или мезенхиме выделяют
дистрофии:
-
паренхиматозные,
-
мезенхимальные,
-
смешанные.
По преобладанию
нарушений того или иного обмена веществ
в паренхиме
или мезенхиме различают дистрофии:
-
паренхиматозные:
а) протеинозы или
белковые – зернистая, вакуольная
(гидропическая), гиалиново-капельная,
роговая и др.;
б) липидозы или
жировые;
в) глюцидозы или
углеводные;
г) минералозы или
минеральные;
д) калькулезы,
литиазы – образование камней;
-
мезенхимальные:
а) протеинозы –
гиалиноз (гомогенные белковые массы,
содержащие особые гликопротеиды),
амилоидоз – белковые массы, содержащие
специфические гликопротеиды: комплекс
глобулинов и полисахаридов),
б) липидозы,
в) глюцидозы.
3) смешанные, к
которым относятся:
а) хромопротеидозы,
б) нуклеопротеидозы,
в) минералозы и
др.
В качестве
иллюстрации рассмотрим наиболее часто
встречающиеся виды белковой паренхиматозной
дистрофии.
Развитие патологии
 В результате одной или нескольких из указанных выше причин нарушается регуляция систем, которые обеспечивают трофику кожи. Как результат, развивается энергетический дефицит, ферменты, обеспечивающие бесперебойное течение метаболических процессов, перестают работать в полную силу – из-за этого и развиваются дистрофические нарушения кожи.
В результате одной или нескольких из указанных выше причин нарушается регуляция систем, которые обеспечивают трофику кожи. Как результат, развивается энергетический дефицит, ферменты, обеспечивающие бесперебойное течение метаболических процессов, перестают работать в полную силу – из-за этого и развиваются дистрофические нарушения кожи.
Имеет также значение поломка транспортных систем, благодаря которым питание тканей кожи поддерживается на надлежащем уровне – это кровеносная и лимфатическая системы. При нарушении с их стороны страдает поставка кислорода и питательных веществ в кожу.
Выявлено, что далее такие нарушения запускают сбои нейроэндокринного характера, так как эндокринные железы и нервная система, которые обеспечивают управление метаболических процессов в коже, страдают от нехватки питательных веществ. Формируется замкнутый круг, в котором нарушение со стороны одних звеньев влечет нарушение других – и так по кругу.
Одновременно присоединяются обменные сбои, в результате которых развивается жировая и белковая инфильтрация тканей, запускается синтез аномальных веществ типа амилоида (белково-полисахаридного комплекс, которого в норме в тканях нет, а его наличие мешает им выполнять свои функциональные обязанности).
Важно
Главной проблемой дистрофии кожи является то, что достигнув какого-то уровня, она без корректировки становится необратимой. Результат этого – старение кожи, причем, инволютивные процессы также являются необратимыми.
Дистрофии кожи бывают разного типа:
- по типу обменных расстройств – белковые, жировые, минеральные, углеводные;
- по распространенности процесса – локальные (местные) и системные;
- по происхождению – врожденные и приобретенные.
Приобретенные дистрофии могут быть:
- самостоятельной патологией;
- признаками других заболеваний.
Среди самостоятельных дистрофических заболеваний кожи чаще всего встречаются:
- старческая дистрофия кожи;
- кожа земледельцев и моряков;
- ромбовидная гипертрофическая кожа шеи;
- диффузная эластома Дюбрeя;
- гиалома;
- эластоидоз кожи узелковый;
- дистрофия кожи пигментно-сосочковая.
Из приобретенных дистрофий кожи, которые являются признаками других заболеваний, чаще всего встречаются следующие:
- белковая;
- гиалиновая;
- амилоидная;
- гидротопическая;
- роговая;
- жировая;
- углеводная;
- минеральная.
Врожденные дистрофии кожи бывают двух видов:
- гиперэластическая дистрофия Унны – наследственное чрезмерное растяжение дермы, которое возникает из-за ухудшения свойств коллагена;
- вялая дистрофия Кетли – наследственная деструкция (разрушение) соединительной ткани кожных покровов.
Исследования и прогресс
С 2005 года для лечения пациентов с развивающимся поражением мышц все чаще используются стволовые клетки. Для лечения мышечной дистрофии этим методом могут быть рассмотрены различные варианты заболевания, такие как: мышечные дистрофии Дюшенна, Беккера, миопатия поясничного и плечевого отдела.
Целью лечения является регенерация потерянных и поврежденных мышечных волокон с использованием регенеративного потенциала стволовых клеток. Для этого большое количество стволовых клеток вводится при помощи нескольких внутривенных и внутримышечных инъекций, что позволяет лучше нацеливать терапию именно на пораженную группу мышц.
Лечение дистрофии

В зависимости от формы и степени тяжести заболевания подбирается комплекс терапевтических мер. Если дистрофия имеет вторичный характер, лечится патология, ставшая ее причиной
При первичном развитии внимание уделяется коррекции питания с помощью диеты, которая сочетается с медикаментозным лечением, массажем, гимнастикой. Проводится санация хронических инфекций
Для гипотрофии 1 стадии госпитализация необязательна.
При критической потере массы тела, тяжелых формах лечение проводится в стационаре.
Больной изолируется в боксе, где поддерживаются оптимальная температура, влажность, обеспечивается защита от внешних раздражителей.
Диетотерапия
Цель метода – восстановление дефицита питательных веществ. Лечебное питание назначается с учетом порога толерантности больного к пище. Кормление проводится часто, маленькими дробными порциями (7–10 раз в день). Объем пищи постепенно увеличивается.
В дневнике питания записываются ее количество и качество, изменения стула, частота мочеиспускания.
Диета при дистрофии состоит из 3 этапов:
- Адаптационный. Восстанавливает функцию пищеварительной системы, позволяет вывести продукты распада, определить переносимость к пище. Для этого уменьшается ее суточная норма на 30–60%, в зависимости от стадии заболевания, в течение 2–7 дней. Пища принимается через каждые 2–3 часа.
- Репарационный. Переводит организм на нормальный режим питания. Объём пищи постепенно увеличивается, в состав включается необходимое количество белков, жиров, углеводов. Частота приема пищи уменьшается на 1–2 раза. Этап длится около 3 недель.
- Завершающий. Продолжается до восстановления пищеварительной функции, нормального веса. Частота трапезы сокращается еще на 1 раз, порции увеличиваются, калорийность продуктов повышается.
Медикаментозное лечение
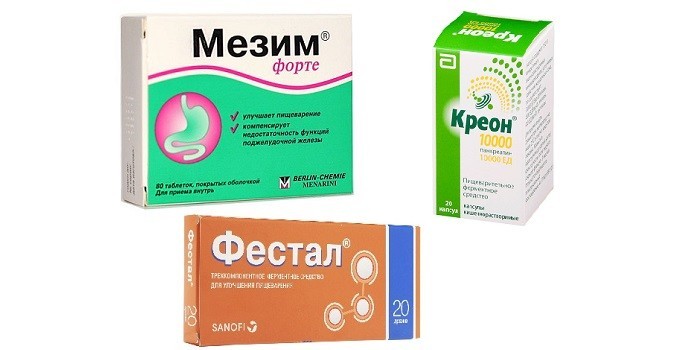
Терапия лекарственными препаратами направлена на восстановление метаболических процессов:
- для усвояемости пищи назначаются ферменты Мезим, Фестал, Креон;
- внутривенно вводятся растворы белковых гидролизаторов – Альбумин или Левамин;
- назначаются курсы витаминов групп В и С, прием биологических добавок с микроэлементами, иммуностимуляторов;
- при тяжелых формах алиментарной дистрофии проводится переливание крови.
Патогенез
В основе развития врожденных прогрессирующих миопатий — мутации на Х-хромосоме человека в гене DMD, кодирующего белок дистрофина, который является структурным компонентом мышечной ткани с локализацией в мембране скелетных мышечных волокон и клетках сердечной мышцы (кардиомиоцитов).
Дистрофин — важнейший компонент, участвующий в формировании устойчивой связи между внеклеточным матриксом и цитоскелетом мышечных волокон. При отсутствии/дефекте дистрофина мышечные волокна приобретают хрупкость, что вызывает разрыв и увеличение проницаемости мембран при сокращении мышц и, соответственно, выход растворимых ферментов из клеток (креатинкиназа) в обмен на ионы кальция, что способствует активации фермента фосфолипаза и обуславливает дальнейшее повышение проницаемости мембран. Увеличение на ранней стадии заболевания уровня активных форм кислорода также способствует перекисному окислению липидов и последующему повреждению мембран мышечных клеток, открытию ионных каналов.
Патоморфологические изменения происходят преимущественно в мышцах и выражаются атрофией отдельных мышечных волокон. При этом, миофибриллы утрачивают поперечную сегментацию, а зачастую и полностью разрушаются. Ядра мышечных клеток становятся крупнее и в них появляются различного рода включения. На месте атрофированных мышечных волокон интенсивно разрастается соединительная/жировая ткань. Выраженные изменения происходят и в сосудах мышц, в которых прослеживается выраженная тенденция к сужению и образованию тромбов. Нервные волокна остаются относительно сохранными.
Диагностика
Диагноз «дистрофия» ставят на основе признаков, которые характерны для данного заболевания. Это соотношение веса к росту, количество подкожной жировой клетчатки, особенности тургора тканей. Врач анализирует влияние различных внешних факторов на организм больного и его сопротивляемость инфекциям.
Для определения степени дистрофии проводят лабораторные исследования. Гипотрофию 1 степени определяют по результатам анализа крови и секреции желудка. Снижение активности ферментов пищеварения и нарушение баланса между фракциями белков крови могут свидетельствовать о патологии. На 2 стадии гипотрофии ярко выражена гипохромная анемия, снижается количество гемоглобина. 3 стадия характеризуется сгущением крови и замедлением СОЭ. В моче обнаруживаются хлориды, фосфаты, мочевина.
Для определения паратрофии и гипостатуры проводят дифференциальную диагностику, изучение генетического анамнеза. Недостаток роста может оказаться результатом наследственной конституциональной низкорослости.
Виды дистрофии
В результате длительного вынужденного или осознанного голодания у взрослых развивается алиментарная дистрофия. Она характеризуется общим истощением организма, нарушением всех обменных процессов, вызывает тяжелые соматические и психические заболевания, бесплодие у женщин.
Дистрофия у детей имеет несколько разновидностей. При перекорме новорожденного, преобладании в рационе питания углеводов и недостатке белка возникает паратрофия. Она выражается в избыточной массе тела по отношению к его длине. Еще один вид дистрофии – гипостатура – отличается отставанием роста и недостатком веса относительно возраста.
Самый распространенный тип дегенеративного изменения – гипотрофия. Она характеризуется дефицитом веса по отношению к длине тела, представляет опасность для ребенка. Может развиваться как в пренатальный, так и в постнатальный период.
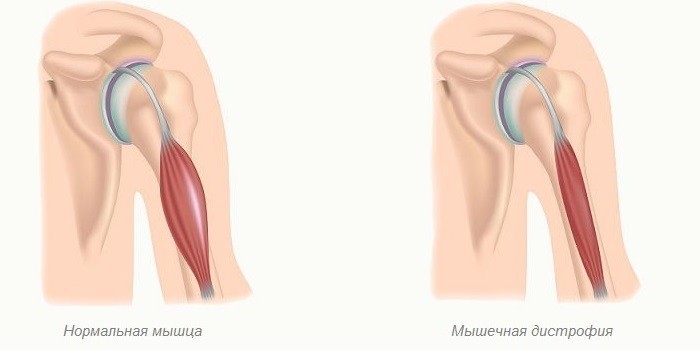
Мышечная дистрофия – наследственное заболевание.
Дегенерации подвергается мускулатура, поддерживающая костный скелет. Болезнь характеризуется частичной или полной утратой двигательных способностей, атрофией мышц. Полностью вылечить ее нельзя. Жировая дистрофия разрушает печень. Выявить заболевание сложно из-за отсутствия симптомов. Часто диагноз ставится на стадии формирования цирроза. Вызывают его гормональные нарушения, сахарный диабет, злоупотребление алкоголем.
Для выявления причин и борьбы с заболеванием разработана обширная система классификаций:
- По происхождению: первичная патология возникает в результате недостатка энергетических веществ, вторичная протекает на фоне других заболеваний.
- По времени образования: врожденная дистрофия обусловлена генетикой либо вредным воздействием на плод в период развития. Приобретенная развивается под влиянием внешних и внутренних факторов.
- По масштабу распространенности: дистрофия может локализоваться в 1 органе (местная), либо охватывать весь организм (общая).
- В зависимости от того, какие процессы обмена веществ нарушены: белковая, жировая, углеводная, минеральная.
- Исходя из локализации: паренхиматозный процесс протекает в клетках, мезенхимальный развивается в соединительной ткани, смешанный затрагивает одновременно клетки и ткани.
Стромально-сосудистые белковые дистрофии
Среди белковых
стромально-сосудистых дистрофий
выделяют:
-
мукоидное набухание,
-
фибриноидное
набухание, -
гиалиноз,
-
амилоидоз.
Мукоидное
набухание
Определение –
это нетяжелая обратимая дезогранизация
соединительной ткани. В норме в
соединительной ткани белки и гиалуроновая
кислота находятся в связанном состоянии
в виде белково-полисахаридных комплексов.
При патологии эта связь нарушается и
гиалуроновая кислота накапливается в
соединительной в свободном состоянии,
в большом количестве. Гиалуроновая
кислота повышает проницаемость сосудов,
что ведет к выходу плазмы в соединительную
ткань (плазморрагия
и плазмотическое пропитывание).
Это ведет к набуханию волокон соединительной
ткани и набуханию основного вещества.
Этиология
— ревматические
болезни, инфекционные болезни, гипоксия.
Морфогенетические
механизмы
— декомпозиция, инфильтрация.
Патоморфология
Макро
– изменений нет. Микро
— Набухает
основное вещество и волокна соединительной
ткани. При окраске толуидиновым
синим определяется
метахромазия
соединительной
ткани. Метахромазия
– это окраска ткани в цвет, отличающийся
от цвета красителя. В данном случае
вместо синей окраски появляется розовая
окраска ткани.
Локализация:
стенка
сосудов, оболочки сердца.
Исходы:
при
благоприятном исходе происходит
восстановление структуры ткани, при
неблагоприятном – переход в фибриноидное
набухание.
Функция:
изменена
незначительно.
Фибриноидное
набухание
Определение –
это тяжелая необратимая дистрофия при
которой происходит деструкция
соединительной ткани, резкое повышение
проницаемости сосудов и образование
фибриноида. Это вещество состоит из
разрушенных элементов соединительной
ткани, которые вступают в прочную связь
с белком плазмы крови – фибриногеном.
Этиология
– ревматические
болезни, аллергические реакции,
артериальные гипертензии, гипоксия.
Морфогенетические
механизмы – декомпозиция,
инфильтрация.
Патоморфология:
Макро
– изменений нет. Микро
– волокна
соединительной ткани в очагах фибриноида
становятся гомогенными, их структура
не сохраняется. ШИК-реакция +, эозинофилия,
метахромазии нет.
Локализация:
стенки мелких артерий при артериальных
гипертензиях, соединительная ткань
эндокарда при ревматизме, дно хронической
язвы желудка, хронический аппендицит.
Исходы:
всегда
неблагоприятный – переход в гиалиноз,
фибриноидный некроз, склероз (замещение
соединительной тканью).
Гиалиноз
Определение –
это дистрофия при которой в соединительной
ткани появляется особое вещество –
гиалин.
Это вещество имеет вид плотных,
полупрозрачных, однородных масс, которые
напоминают гиалиновый хрящ.
Профилактика
Профилактикой дистрофии лучше заняться еще до рождения ребенка. Профилактические меры можно разделить на 2 группы:
Антенатальная:
- борьба с абортами и инфекциями женских половых органов;
- предупреждение токсикозов;
- профилактика заболеваний, которые сопровождаются ацидозом внутренней среды;
- исключение стрессов;
- соблюдение гигиенических условий быта, питания, режима и т.д.
Постнатальная:
- естественное вскармливание;
- соблюдение режима и питания кормящей женщины;
- правильное введение прикорма;
- полноценный уход за ребенком (контролировать набор веса измерять динамику роста и т.д.);
- профилактика и лечение заболеваний (особенно органов ЖКТ).
Паренхиматозные белковые дистрофии (диспротеинозы)
Большая часть белков цитоплазмы (простых
и сложных) находится в соединении с
липидами, образуя липопротеидные
комплексы. Эти комплексы составляют
основу мембран митохондрий,
эндоплазматической сети, пластинчатого
комплекса и других структур. Помимо
связанных белков, в цитоплазме содержатся
и свободные. Многие из последних обладают
функцией ферментов.
Сущность паренхиматозных диспротеинозов
состоит в изменении физико-химических
и морфологических свойств белков клетки:
они подвергаются
денатурации и коагуляции или, наоборот,
колликвации, что ведет к гидратации
цитоплазмы; в тех случаях, когда нарушаются
связи белков с липидами, возникает
деструкция мембранных структур клетки.
В исходе этих нарушений может развиться
коагуляционный (сухой) или
колликвационный (влажный) некроз
(схема 1).
К паренхиматозным диспротеинозам
относят гиалиново-капельную,
гидропическую и роговую дистрофии.
К паренхиматозным белковым дистрофиям
со времен Р. Вирхова причисляли и многие
патологи продолжают причислять так
называемую зернистую дистрофию,
при которой в клетках паренхиматозных
органов появляются белковые зерна. Сами
органы увеличиваются в размерах,
становятся дряблыми и тусклыми на
разрезе, что послужило причиной называть
также зернистую дистрофию тусклым
(мутным) набуханием. Однако
электронно-микроскопическое и
гистоферментохимическое изучение
«зернистой дистрофии» показало,
что в ее основе лежит не накопление
белка в цитоплазме, а гиперплазия
ультраструктур клеток паренхиматозных
органов как выражение функционального
напряжения этих органов в ответ на
различные воздействия; гиперплазированные
ультраструктуры клетки выявляются при
светооптическом исследовании как
белковые гранулы.
Что такое дистрофические явления и их виды
Такое состояние, как дистрофические изменения в теле, возникает у людей, имеющих проблемы с обменом веществ. Под действием определенных факторов в теле человека возникают повреждения клеток и пространства между ними, что ведет к нарушению функциональных особенностей того органа, в котором такие процессы возникли.
По выполняемым функциям трофики разделяют на клеточные и внеклеточные. В зависимости от того, какой трофик подвергается изменениям, зависит и вид приобретаемой дистрофии, а также ее симптомы.
Больше всего данному недугу подвержены дети первых трех лет жизни. Но возникает заболевание и у взрослых под действием ряда факторов. Существует даже такой вид патологии, как хронические дистрофические изменения – болезнь, симптомы которой у некоторых людей проявляются каждые 2-3 года. Но лечение этой болезни дает неплохие результаты и при соблюдении определенных требований периоды обострения становятся более редкими.

Данное заболевание легко может распространяться на все тело, тогда оно попадает под классификацию «системное», т. е. общее, а может локализоваться в одном органе. В этом случае недуг называется местным
Такое разделение крайне важно, т. к
лечение, как и симптомы, в данном случае, совершенно разные.
Важна и этиология заболевания. Причины и симптомы приобретенной и врожденной дистрофии имеют существенные отличия. Врожденное заболевание начинает проявлять себя с первых же месяцев жизни малыша.
Объясняется такой недуг просто: у ребенка генетически заложен дефицит тех или иных веществ, участвующих в метаболических процессах. Как результат – накопление в тканях тела не расщепленных белков, жиров или углеводов, которые в итоге становятся причиной нарушения функционирования того или иного органа. В обязательном порядке возникают необратимые процессы в нервной системе. Лечение врожденной дистрофии невозможно, а потому летальный исход наступает в 100% случаев: большинство детей с врожденной дистрофией не доживают даже до первого дня рождения.