Лизосомы мышечных волокон
Содержание:
- Содержание
- Саркомер
- Механизм участия атф в сокращении
- Типы гипертрофии мышечных волокон
- Коллаген
- Навигация
- Структура
- Типирование волокна
- Источник энергии для сокращения[править]
- Строение миофибрилл[править]
- 12.2.1. Особенности структуры и состава миоцитов
- Основные отличия нитевидных белков от сферических
- Навигация
- Литература[править]
- Мышечная ткань
- Митохондрии
- Функция
Содержание
Саркомер
Саркомер — часть миофибриллы, расположенная между двумя последовательными Z–дисками. В состоянии покоя и полностью растянутой мышце длина саркомера составляет 2 мкм. При такой длине саркомера актиновые (тонкие) нити лишь частично перекрывают миозиновые (толстые) нити. Один конец тонкой нити прикреплён к Z-линии, а другой конец направлен к середине сaркомера.
Толстые нити занимают центральную часть сaркомера — А–диск (содержащий только толстые нити участок сaркомера — Н-зона, в середине Н-зоны проходит М-линия). I–диск входит в состав двух сaркомеров. Следовательно, каждый сaркомер содержит один А–диск (тёмный) и две половины I–диска (светлого), формула саркомера — 0,5А + I + 0,5А. Во время сокращения длина A–диска не меняется, а I–диска — укорачивается, что и послужило основанием для создания теории, объясняющей сокращение мышцы механизмом скольжения (теория скольжения) тонких актиновых нитей вдоль толстых миозиновых.
Механизм участия атф в сокращении
Условие:
закончился очередной цикл взаимодействия
тонких и толстых МФ, но между ними ещё
сохраняются мостики
1)Связывание
АТФ и разрыв мостиков
Молекулы
АТФ связываются с головками миозина
(в соотношении 1:1), и только это приводит
к отсоединению головок от тонких МФ
(т.е. разрыву мостиков). Поэтому после
смерти развивается трупное окоченение:
в отсутствие АТФ мостики
между МФ
(образовавшиеся в результате гидролиза
последних запасов АТФ) не могут
разорваться.
2)Гидролиз
АТФ и изменение конформации миозина
Головки
миозина гидролизуют АТФ до АДФ и фосфата;
при этом каждая головка принимает
напряжённую конформацию (за счёт энергии
гидролиза АТФ) и сохраняет связь с АДФ.
3)Замыкание
мостиков Изменение конформации головок
делает возможным их
взаимодействие
с тонкими МФ — замыкание мостиков.
4)Перемещение
МФ Головки миозина, стремясь вернуться
в ненапряжённое состояние, развивают
тянущее усилие, которое приводит к
перемещению толстых и тонких МФ друг
относительно друга. Одновременно
диссоциирует АДФ, что делает возможным
в следующем цикле связывание очередных
молекул АТФ и разрыв мостиков.
Таким
образом, энергия гидролиза АТФ вначале
переходит в энергию напряжённой
конформации миозина, которая затем
используется для совершения механической
работы (относительного перемещения
МФ).
Типы гипертрофии мышечных волокон
Устройство мышечного волокна
Можно выделить два крайних типа гипертрофии мышечных волокон: миофибриллярную гипертрофию и саркоплазматическую гипертрофию.
Миофибриллярная гипертрофия мышечных волокон – увеличение объема мышечных волокон за счет увеличения объема и числа миофибрилл. При этом возрастает плотность укладки миофибрилл в мышечном волокне. Гипертрофия мышечных волокон ведет к значительному росту максимальной силы мышцы. Наиболее предрасположены к миофибриллярной гипертрофии быстрые (IIB тип) мышечные волокна и в меньшей степени IIА типа.
Саркоплазматическая гипертрофия мышечных волокон – увеличение объема мышечных волокон за счет преимущественного увеличения объема саркоплазмы, т. е. несократительной их части. Гипертрофия этого типа происходит за счет повышения содержания в мышечных волокнах митохондрий, а также: креатинфосфата, гликогена, миоглобина и др. Наиболее предрасположены к саркоплазматической гипертрофии медленные (I) и быстрые окислительные (IIА) мышечные волокна. Саркоплазматическая гипертрофия мышечных волокон мало влияет на рост силы мышц, но зато значительно повышает способность к продолжительной работе, т. е. увеличивает их выносливость.
Миофибриллярная и саркоплазматическая гипертрофия мышц
В реальных ситуациях гипертрофия мышечных волокон представляет собой комбинацию двух названных типов с преобладанием одного из них. Преимущественное развитие того или иного типа гипертрофии мышечных волокон определяется характером тренировки. Упражнения со значительными внешними отягощениями (более 70%-от максимума), способствуют развитию миофибриллярной гипертрофии мышечных волокон. Такой тип гипертрофии характерен для силовых видов спорта (тяжелая атлетика, пауэрлифтинг). Длительное выполнение двигательных действий, развивающих выносливость, с относительно небольшой силовой нагрузкой на мышцы вызывает, главным образом, саркоплазматическую гипертрофию мышечных волокон. Такая гипертрофия свойственна бегунам на средние и длинные дистанции. Спортсменам, занимающихся бодибилдингом, свойственна как миофибриллярная, так и саркоплазматическая гипертрофия мышечных волокон.
Нередко к гипертрофии относят и гиперплазию мышцы (увеличение количества волокон), однако последние исследования показали, что вклад гиперплазии в объем мышцы составляет менее 5% и носит более существенный характер только при использовании анаболических стероидов. Гормон роста при этом не вызывает гиперплазии. Таким образом, люди склонные к гипертрофии, как правило, имеют большее количество мышечных волокон. Общее число волокон заложено генетически и практически не меняется в течение жизни без применения специальной фармакологии.
Коллаген
Коллаген — самый распространенный фибриллярный протеин многоклеточных животных. Он входит в состав соединительной ткани, обеспечивая ее прочность и эластические свойства. Этот белок присутствует в:
- хрящах;
- дерме;
- сухожилиях;
- органическом матриксе костей;
- стенках сосудов;
- органическом материале костной ткани.
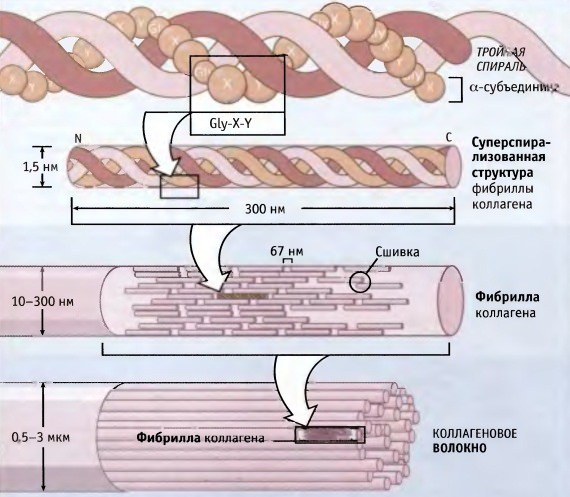
Коллаген состоит из трех аминокислотных цепей, скрученных в спираль и соединенных друг с другом ковалентными связями. Структурные единицы этого белка называются тропоколлагенами. Последние соединяются друг с другом концами, смещенными друг относительно друга на расстояние в 67 нанометров.
В зависимости от локализации в организме различают 28 типов коллагена. У всех разновидностей обязательно присутствует хотя бы один домен с тройной спиралью. Коллаген составляет основу всех типов соединительной ткани. Структурные компоненты этого белка образуют очень прочные фибриллы, которые способны выдерживать значительные нагрузки.

Коллаген выполняет опорные и защитные функции, а также обеспечивает эластичность тканей. Однако молекулы этого протеина не обладают способностью растягиваться. Резиноподобные свойства характерны для другого белка, также присутствующего в соединительных тканях, — эластина.
Навигация
Инструменты
- Ссылки сюда
- Служебные страницы
- Версия для печати
- Постоянная ссылка
- Сведения о странице
- Цитировать страницу
- Просмотреть свойства
Структура
Нити миофибрилл, миофиламенты бывают двух типов: толстые и тонкие:
- Тонкие нити состоят в основном из протеина актина , свернутого спиралями небулиновых нитей. Актин, когда полимеризуется в филаменты, образует «лестницу», по которой миозиновые филаменты «поднимаются» для создания движения.
- Толстые волокна состоят в основном из белкового миозина , удерживаемого на месте нитями тайтина . Миозин отвечает за генерацию силы. Он состоит из глобулярной головки с сайтами связывания АТФ и актина и длинного хвоста, участвующего в его полимеризации в миозиновые филаменты.
Белковый комплекс, состоящий из актина и миозина, иногда называют «актиномиозином».
В поперечно-полосатых мышцах, таких как скелетные и сердечные мышцы , актиновые и миозиновые филаменты имеют определенную и постоянную длину порядка нескольких микрометров, что намного меньше длины удлиненной мышечной клетки (несколько миллиметров в случае человека. клетки скелетных мышц). Филаменты организованы в повторяющиеся субъединицы по длине миофибриллы. Эти субъединицы называются саркомерами . Мышечная клетка почти заполнена миофибриллами, идущими параллельно друг другу по длинной оси клетки. Саркомерные субъединицы одной миофибриллы почти идеально совмещены с таковыми миофибрилл рядом с ней. Это выравнивание приводит к определенным оптическим свойствам, из-за которых клетка выглядит полосатой или полосатой. В гладкомышечных клетках это выравнивание отсутствует, следовательно, нет видимых полосок, и клетки называются гладкими. Открытые мышечные клетки под определенными углами, например, в мясных отрезах , могут иметь структурную окраску или радужную окраску из-за этого периодического выравнивания фибрилл и саркомеров.
Внешность
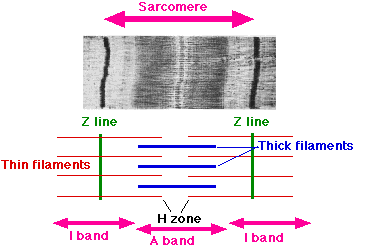
Названия различных подобластей саркомера основаны на их относительно более светлом или более темном виде при просмотре в световой микроскоп. Каждый саркомер ограничен двумя полосами очень темного цвета, называемыми Z-дисками или Z-линиями (от немецкого zwischen, что означает «между»). Эти Z-диски представляют собой плотные белковые диски, которые не пропускают свет. В этой области присутствует Т-трубочка . Область между Z-дисками дополнительно разделена на две полосы более светлого цвета с обоих концов, которые называются I-полосами, и более темную сероватую полосу посередине, называемую полосой A.
Полосы I кажутся более светлыми, потому что эти области саркомера в основном содержат тонкие актиновые нити, меньший диаметр которых позволяет свету проходить между ними. С другой стороны, полоса А содержит в основном миозиновые волокна, больший диаметр которых ограничивает прохождение света. A означает анизотропный, а I — изотропный , что относится к оптическим свойствам живой мышцы, продемонстрированным с помощью микроскопии в поляризованном свете .
Части полосы A, которые примыкают к полосам I, заняты как актиновыми, так и миозиновыми филаментами (где они пересекаются, как описано выше). Также в полосе A находится относительно более яркая центральная область, называемая H-зоной (от немецкого helle , что означает яркий), в которой нет перекрытия актина / миозина, когда мышца находится в расслабленном состоянии. Наконец, H-зона делится пополам темной центральной линией, называемой M-линией (от немецкого mittel, означающего середину).
Типирование волокна
Окрашивание поперечного сечения мышцы АТФазой. Волокна типа II темные из-за щелочного pH препарата. В этом примере размер волокон типа II значительно меньше размера волокон типа I из-за денервационной атрофии.
Существует множество методов, используемых для типирования волокон, и неспециалисты часто путают их. Часто путают два метода: гистохимическое окрашивание для определения активности миозин-АТФазы и иммуногистохимическое окрашивание для определения типа тяжелой цепи миозина (MHC). Активность миозин-АТФазы обычно — и правильно — называют просто «типом волокна», и она является результатом прямого анализа активности АТФазы в различных условиях (например, pH ). Окрашивание тяжелой цепи миозина наиболее точно называют «типом волокна MHC», например «волокном MHC IIa», и оно является результатом определения различных изоформ MHC . Эти методы тесно связаны физиологически, поскольку тип MHC является основным фактором, определяющим активность АТФазы
Обратите внимание, однако, что ни один из этих методов типирования не имеет прямого метаболического характера; они не касаются напрямую окислительной или гликолитической способности волокна. Когда волокна «типа I» или «типа II» упоминаются в целом, это наиболее точно относится к сумме числовых типов волокон (I против II), оцениваемых по окрашиванию активности миозиновой АТФазы (например, волокна «типа II» относятся к типу IIA + тип IIAX + тип IIXA ..
и т. Д.).
Ниже приведена таблица, показывающая взаимосвязь между этими двумя методами, ограниченная типами клетчатки, обнаруженными у людей
Обратите внимание на заглавные буквы подтипа, используемые при типировании волокон по сравнению с типированием MHC, и что некоторые типы ATPase фактически содержат несколько типов MHC. Кроме того, подтип B или b не экспрессируется у людей ни одним из методов
Ранние исследователи полагали, что люди экспрессируют MHC IIb, что привело к классификации IIB по АТФазе. Однако более поздние исследования показали, что человеческий MHC IIb на самом деле был IIx, что указывает на то, что IIB лучше называть IIX. IIb экспрессируется у других млекопитающих, поэтому до сих пор точно встречается (вместе с IIB) в литературе. Типы волокон, отличных от человека, включают настоящие волокна IIb, IIc, IId и т. Д.
| Тип АТФазы | Тяжелая цепь (и) MHC |
|---|---|
| Тип I | MHC Iβ |
| Тип IC | MHC Iβ> MHC IIa |
| Тип IIC | MHC IIa> MHC Iβ |
| Тип IIA | MHC IIa |
| Тип IIAX | MHC IIa> MHC IIx |
| Тип IIXA | MHC IIx> MHC IIa |
| Тип IIX | MHC IIx |
Другие методы типирования волокна менее формально определены и существуют в большей части спектра. Они, как правило, больше сосредоточены на метаболических и функциональных возможностях (например, окислительное или гликолитическое , быстрое или медленное сокращение). Как отмечалось выше, типирование волокон с помощью АТФазы или MHC напрямую не измеряет и не определяет эти параметры. Однако многие из различных методов механически связаны, в то время как другие коррелируют in vivo . Например, тип волокна АТФазы связан со скоростью сокращения, потому что высокая активность АТФазы позволяет быстрее . В то время как активность АТФазы является только одним из компонентов скорости сокращения, волокна типа I «медленные», отчасти потому, что они имеют низкие скорости активности АТФазы по сравнению с волокнами типа II. Однако измерение скорости сокращения — это не то же самое, что типирование волокна АТФазой.
Из-за этих типов взаимоотношений волокна Типа I и Типа II обладают относительно разными метаболическими, сократительными и моторными свойствами. В таблице ниже представлены эти типы свойств. Эти типы свойств — хотя они частично зависят от свойств отдельных волокон — имеют тенденцию быть актуальными и измеряться на уровне двигательной единицы , а не отдельного волокна.
| Свойства | Волокна типа I | Волокна типа IIA | Волокна типа IIX |
|---|---|---|---|
| Тип блока двигателя | Медленное окисление (SO) | Быстрое окисление / гликолитик (ВОГ) | Быстрый гликолитик (ФГ) |
| Скорость подергивания | Медленный | Быстрый | Быстрый |
| Сила подергивания | Небольшой | средний | Большой |
| Устойчивость к переутомлению | Высоко | Высоко | Низкий |
| Содержание гликогена | Низкий | Высоко | Высоко |
| Капиллярная подача | Богатые | Богатые | Бедных |
| Миоглобин | Высоко | Высоко | Низкий |
| красный цвет | Темно | Темно | Бледный |
| Плотность митохондрий | Высоко | Высоко | Низкий |
| Капиллярная плотность | Высоко | Средний | Низкий |
| Емкость окислительного фермента | Высоко | Средний-высокий | Низкий |
| Ширина Z-линии | Средний | Широкий | Узкий |
| Щелочная активность АТФазы | Низкий | Высоко | Высоко |
| Кислая активность АТФазы | Высоко | Средней высоты | Низкий |
- Цвет волокна
Традиционно волокна классифицируются в зависимости от их цвета, который отражает содержание миоглобина . Волокна типа I кажутся красными из-за высокого уровня миоглобина. Красные мышечные волокна, как правило, имеют больше митохондрий и большую локальную плотность капилляров. Эти волокна больше подходят для выносливости и медленно утомляются, поскольку они используют окислительный метаболизм для выработки АТФ ( аденозинтрифосфата ). Волокна типа II с меньшей окислительной способностью имеют белый цвет из-за относительно низкого уровня миоглобина и зависимости от гликолитических ферментов.
- Скорость подергивания
Волокна также можно разделить на быстрые и медленные по их способности сокращаться. Эти признаки в значительной степени, но не полностью, перекрывают классификации, основанные на цвете, АТФазе или MHC.
Некоторые авторы определяют быстро сокращающееся волокно как волокно, в котором миозин может очень быстро расщеплять АТФ. В основном это волокна АТФазы типа II и MHC типа II. Однако быстросокращающиеся волокна также демонстрируют более высокую способность к электрохимической передаче потенциалов действия и быстрый уровень высвобождения и поглощения кальция саркоплазматическим ретикулумом. Быстросокращающиеся волокна полагаются на хорошо развитую краткосрочную гликолитическую систему для передачи энергии и могут сокращаться и развивать напряжение в 2–3 раза быстрее, чем медленные волокна. Быстро сокращающиеся мышцы намного лучше генерируют короткие всплески силы или скорости, чем медленные, и поэтому быстрее утомляются.
Медленно сокращающиеся волокна генерируют энергию для повторного синтеза АТФ посредством долгосрочной системы передачи энергии. В основном это волокна АТФазы типа I и MHC типа I. Они, как правило, имеют низкий уровень активности АТФазы, более медленную скорость сокращения с менее развитой гликолитической способностью. Они содержат большой объем митохондрий и высокий уровень миоглобина, который придает им красную пигментацию. Было продемонстрировано, что они имеют высокие концентрации митохондриальных ферментов, поэтому они устойчивы к усталости. Медленно сокращающиеся мышцы работают медленнее, чем быстро сокращающиеся волокна, но они способны сокращаться дольше, прежде чем утомятся.
- Распределение типов
Отдельные мышцы, как правило, представляют собой смесь различных типов волокон, но их пропорции варьируются в зависимости от действий этой мышцы и вида. Например, у человека четырехглавые мышцы содержат ~ 52% волокон типа I, в то время как камбаловидная мышца составляет ~ 80% типа I. Круговая мышца глаза составляет лишь ~ 15% типа I. Двигательные единицы внутри мышцы, однако, имеют минимальные различия между волокнами этого устройства. Именно этот факт делает жизнеспособным принцип размера рекрутирования моторных единиц .
Традиционно считалось, что общее количество волокон скелетных мышц не меняется. Считается, что в распределении волокон нет никаких половых или возрастных различий; однако пропорции типов волокон значительно различаются от мышцы к мышце и от человека к человеку. Сидячие мужчины и женщины (а также маленькие дети) имеют 45% волокон типа II и 55% волокон типа I. Люди, занимающиеся более высокими уровнями в любом виде спорта, склонны демонстрировать закономерности распределения волокон, например, у спортсменов на выносливость наблюдается более высокий уровень волокон типа I. С другой стороны, спортсменам-спринтерам требуется большое количество волокон типа IIX. Спортсмены на средние дистанции демонстрируют примерно равное распределение двух типов. Это также часто бывает у силовых атлетов, таких как метатели и прыгуны. Было высказано предположение, что различные виды упражнений могут вызывать изменения в волокнах скелетных мышц. Считается, что если вы выполняете упражнения на выносливость в течение длительного периода времени, некоторые волокна типа IIX превращаются в волокна типа IIA. Однако единого мнения по этому поводу нет. Вполне возможно, что волокна типа IIX демонстрируют усиление окислительной способности после высокоинтенсивной тренировки на выносливость, которая выводит их на уровень, на котором они способны осуществлять окислительный метаболизм так же эффективно, как медленно сокращающиеся волокна нетренированных субъектов. Это может быть вызвано увеличением размера и количества митохондрий и связанными с ними изменениями, а не изменением типа волокна.
Источник энергии для сокращения[править]
Взаимодействие этих фибриллярных белков атина и меозина лежит в основе феномена сокращения самых различных контрактильных органелл и органов движения (см. Мышцы). Периодические изменение физического состояния мышечных белков, обусловливающее возможность попеременного сокращения и расслабления мышц и выполнения ими механической работы, очевидно, связано с определёнными дающими энергию биохимическими процессами. Энгельгардтом и Любимовой (1939—42) было обнаружено, что особым образом приготовленные из миозина нити при взаимодействии с раствором АТФ резко изменяют свои механические свойства (эластичность и растяжимость). Одновременно происходит расщепление АТФ с образованием АДФ и неорганического фосфата. Это открытие заложило фундамент для нового направления в биохимии — механохимии М. с. В дальнейшем Сент-Дьёрдьи и Штрауб показали, что истинным сократительным белком является не миозин, а его комплекс с актином — актомиозин. Сокращению при взаимодействии с АТФ подвергаются как вымоченные в воде или 50%-ном глицерине мышечные волокна, так и нити, приготовленные из актомиозиновых гелей (синерезис геля). Эти опыты подтверждают, что энергия, необходимая для сокращения мышц, освобождается в результате взаимодействия актомиозина с АТФ с расщеплением последнего на АДФ и H3PO4. При этом освобождается большое количество энергии (8—10 ккал, или 33,5—41,9 кдж, на 1 моль АТФ). Однако истинный механизм этой реакции остаётся всё ещё неясным.
Строение миофибрилл[править]
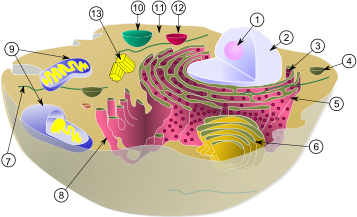
Рис.1.Цитоплазма вместе с её компонентами (органеллами), в типичной животной клетке: (1) Ядрышко (2) Ядро (3) Рибосома (маленькие точки) (4) Везикула (5) Шероховатый эндоплазматический ретикулум (ER) (6) Аппарат Гольджи (7) Цитоскелет (8) Гладкий эндоплазматический ретикулум (9) Митохондрии (10) Вакуоль (11) Цитоплазма (12) Лизосома (13) Центриоль и Центросома
В цитоплазме (cм. рис.1) имеется большое количество клеток миофибрилл с её компонентами органеллами, обеспечивающих сокращение; миофибриллы состоят из актиновых (тонких) и миозиновых (толстых) микрофибрилл.
Фибриллярные белкиправить
Фибриллы состоят из т.н. фибриллярных белков — белков, имеющих вытянутую нитевидную структуру, в которой соотношение продольной и поперечной осей более 1:10. Полипептидные цепи многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
К фибриллярным белкам относят например, α-кератины (на их долю приходится почти весь сухой вес волос, белки шерсти, рогов, копыт, ногтей, чешуи, перьев), коллаген — белок сухожилий и хрящей, фиброин — белок шёлка).
Большинство фибриллярных белков не растворяются в воде, они обычно обладают особой способностью к формированию пространственной структуры, в которой, помимо слабых связей, участвуют и ковалентные непептидные связи ( в отличие от них, в глобулярных белках основной вклад в стабилизацию конформации молекулы вносят слабые нековалентные взаимодействия).
Актиновая микрофибрилла (тонкая)править
Представляет собой тонкую нить.
Основу актиновой микрофибриллы составляет белок актин, который имеет фибриллярную структуру. На актине есть места для связывания миозина
в поперечнополосатой мышечной ткани. К актину присоединены еще несколько белков, образующих тропонин-тропомиозиновый комплекс:
- тропомиозин — закрывает на молекуле актина места для связывания с миозином
- тропонин С — присоединяет ионы кальция; после присоединения кальция сдвигает молекулу тропомиозина с ее первоначального расположения, что приводит к открытию на молекуле актина мест для связывания с миозином
- тропонин Т и тропонин I — выполняют структурную функцию.
В гладкой мышечной ткани тропонин-тропомиозинового комплекса нет.
Актиновые микрофибриллы прикрепляются к цитоскелету клетки в области Z-линий с помощью специальных белков, таких как альфа-актинин, виментин, десмин.
Миозиновая микрофибрилла (толстая)править
Миозиновая микрофибрилла (толстая) представляет собой толстую нить.
Построена из молекул миозина, имеется множество типов миозина с разной скоростью расщепления АТФ, что обуславливает отличия в скорости сокращения разных мышечных волокон.
Молекула миозина похожа на клюшку для игры в гольф или хоккей, в ней различают головку (это та часть клюшки, которая ударяет по мячу или шайбе) и (рукоятка клюшки). Миозиновая микрофибрилла представляет собой пучек таких клюшек, связанных за рукоятки, причем часть головок смотрит в одну сторону, а часть — в другую (передне-заднее направление).
Участки миозиновых микрофибрилл, где находятся головки, вставлены между актиновыми микрофибриллами. Миозиновые микрофибриллы прикрепляются к цитоскелету клетки в области линии М (середина полоски Н)
головка миозина может:
- 1)поворачиваться,
- 2)прикрепляться к актину,
- 3)расщеплять АТФ, то есть является АТФ-азой
Головка миозина может присоединяться к актину только тогда, когда она содержит АДФ и Фосфат (продукты распада АТФ).
Головка миозина, соединенная с актином, может совершать гребковое движение только в момент, когда от нее отсоединяются АДФ и Фосфат.
Головка миозина может отсоединиться от актина только тогда, когда она присоединяет к себе молекулу АТФ в гладкой мышечной ткани. Головка миозина имеет легкие цепи, которые должны сначала фосфорилироваться, для того чтобы она смогла расщеплять и присоединять АТФ и взаимодействовать с актином.
12.2.1. Особенности структуры и состава миоцитов
1. Основной
особенностью миоцитов,
отличающих их от других клеток, является
наличие сократительных элементов –
миофибрилл.
Миофибриллы занимают большую часть
мышечных клеток, их диаметр около 1
мм.
2. Наличие в
саркоплазме белка миоглобина,
который по строению идентичен субъединице
гемоглобина. Функция
миоглобина заключается в связывании
кислорода.
Благодаря этому белку в мышцах создаётся
определённый запас кислорода.
3. Основной углевод
мышечной ткани – гликоген.
Концентрация гликогена колеблется в
приделах от 0,2 до 3%.
4. Каждое мышечное
волокно окружено клеточной оболочкой
– сарколеммой.
К сарколемме подходят окончания
двигательных нервов. Место контакта
двигательных нервов с сарколеммой
называется
нервно-мышечным
синапсом.
Основные отличия нитевидных белков от сферических
Кроме пространственной формы, фибриллярные белки отличаются от глобулярных по:
- размеру;
- растворимости;
- функциям.
Волокнистые протеины обычно крупнее сферических и представляют собой длинные стержни, сформированные из спиралей. В отличие от глобулярных белков, пространственная конформация фибриллярных обеспечивается за счет сильных водородных связей. По этой причине волокнистые протеины более стабильны и не так легко денатурируют, как сферические.
В отличие от глобулярных белков, фибриллярные:
- не растворяются в воде, а также слабых кислотах и основаниях;
- растворимы в сильных щелочах и кислотах;
- обладают свойствами растяжимости и сжатия;
- характеризуются высокой устойчивостью к пищеварительным ферментам.
Глобулярные белки построены из прямых участков вторичных структур, которые при соединении друг с другом резко меняют направление, формируя трехмерный клубок. Волокнистые протеины состоят из одного элемента, повторяющегося много раз.
Навигация
Инструменты
- Ссылки сюда
- Служебные страницы
- Версия для печати
- Постоянная ссылка
- Сведения о странице
- Цитировать страницу
- Просмотреть свойства
Литература[править]
- Б. Альбертс, Д. Брей, Дж. Льюис, М. Рефф, К. Робертс, Дж. Уотсон, Молекулярная биология клетки — В 3-х т. — Пер. с англ. — Т.2. — М.: Мир, 1994. — 540 с.
- М. Б. Беркинблит, С. М. Глаголев, В. А. Фуралев, Общая биология — В 2-х ч. — Ч.1. — М.:МИРОС, 1999. — 224 с.: ил.
Мышечная ткань
Клетки мышечной ткани, как и нервные, могут возбуждаться при воздействии химических и электрических стимулов. Способность мышечных клеток укорачиваться (сокращаться) в ответ на действие определенного стимула связана с наличием особых белковых структур (миофибрилл). В организме мышечные клетки осуществляют энергосберегающие функции, поскольку энергия, расходуемая при сокращении мышцы, затем выделяется в виде тепла. Поэтому при охлаждении организма происходят частые сокращения мышц (дрожь).
По строению мышечные клетки напоминают другие клетки организма, но отличаются от них формой. Каждая мышечная клетка подобна волокну, длина которого может достигать 20 см. Поэтому часто мышечную клетку называют мышечным волокном.
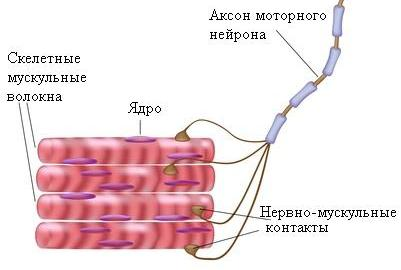
Характерной особенностью мышечных клеток (волокон) является присутствие в них больших количеств белковых структур, которые называются миофибриллами и сокращаются при раздражении клетки. Каждая миофибрилла состоит из коротких белковых волокон, называемых микрофиламенты. В свою очередь, микрофиламенты подразделяются на тонкие актиновые и более толстые миозиновые волокна. Сокращение происходит в ответ на нервное раздражение, которое передается к мышце от двигательной концевой пластинки по нервному отростку посредством нейромедиатора – ацетилхолина.
В соответствии со строением и выполняемыми функциями, выделяют две разновидности мышечной ткани: гладкая и поперечнополосатая.
Митохондрии
1. Количество митохондрий, напротив, не связано с проявлением силы. Однако прямо влияет на проявление локальной выносливости – способности производить работу без утомления в течение всего времени, пока не закончится энергия.
2. В идеале, митохондрии способны полностью «облепить» миофибриллу. И больше этого количества быть уже не может. Следовательно, митохондрии являются зависимыми от миофибрилл по пространству. Они могут появляться лишь вокруг миофибрилл до тех пор, пока есть свободное место.
3. Если в мышечном волокне каждая миофибрилл полностью оплетена митохондриями, то такое мышечное волокна является, в буквальном смысле, неутомимым. Оно будет продолжать работу доступной ему мощности до тех пор, пока организм поставляет необходимое для сокращения горючее – жиры, гликоген или глюкозу из крови. Такие мышечные волокна называются окислительными (более подробная информация в статье Типы мышечных волокон).
4. Митохондрии, в отличие от миофибрилл, растут довольно быстро. По современным данным, за полтора месяца правильной тренировки вполне возможно выйти на пик спортивной формы. Т.е. набрать максимальное для определенной мышцы количество митохондрий.
После этого тренировки по наращиванию митохондрий теряют смысл. Однако можно продолжать поддерживать уже существующее количество митохондрий.
5. Без тренировки митохондрии очень быстро стареют и уничтожаются организмом. Период полураспада составляет 10-20 суток, возможно, даже быстрее.
6. Развитие митохондрий требует своих условий для роста: правильная тренировка и избыточное белковое питание.
7. При периодизации тренировочного цикл, вначале необходимо добиваться существенного роста миофибрилл, а затем уже развивать митохондрии.
8. При одновременной тренировке, упражнения аэробной направленности на развитие митохондрий должны предшествовать силовым упражнениям на увеличение количества миофибрилл.
Вывод: Для увеличения силы необходимо сделать упор на развитие миофибрилл. Для повышения аэробных возможностей организма нужно развивать митохондрии. Развитие и миофибрилл и митохондрий повышает как силовые, так и аэробные возможности тренируемых мышц.
Несмотря на некоторую схематичность, информация, изложенная в статье, является крайне важной для понимания процессов любой тренировки. Потому что миофибриллы и митохондрии – это почти единственное, что удачно поддается тренировке внутри мышечного волокна
(Также мы можем до некоторой степени временно влиять на количество запаса гликогена)
Потому что миофибриллы и митохондрии – это почти единственное, что удачно поддается тренировке внутри мышечного волокна. (Также мы можем до некоторой степени временно влиять на количество запаса гликогена)
Функция
В миозина головки образуют поперечные мостики с актином миофиламентов; здесь они «гребут» вдоль актина. Когда мышечное волокно расслаблено (до сокращения), миозиновая головка имеет связанные с ней АДФ и фосфат.
Когда приходит нервный импульс, ионы Ca 2+ вызывают изменение формы тропонина ; это отодвигает комплекс тропонин + тропомиозин, оставляя участки связывания миозина открытыми.
Головка миозина теперь связывается с миофиламентом актина. Энергия в головке миозинового миофиламента перемещает головку, которая скользит мимо актина; следовательно, выпускается ADP.
АТФ представляет себя (поскольку присутствие ионов кальция активирует АТФазу миозина), и головки миозина отключаются от актина, чтобы захватить АТФ. Затем АТФ расщепляется на АДФ и фосфат. Энергия высвобождается и сохраняется в миозиновой головке, чтобы использовать ее для дальнейшего движения. Головки миозина теперь возвращаются в свое прямое расслабленное положение. Если кальций присутствует, процесс повторяется.
Когда мышца сокращается, актин тянется вдоль миозина к центру саркомера до тех пор, пока нити актина и миозина не будут полностью перекрываться. Зона H становится все меньше и меньше из-за увеличения перекрытия актиновых и миозиновых нитей, и мышца укорачивается. Таким образом, когда мышца полностью сокращена, зона H больше не видна
Обратите внимание, что актиновые и миозиновые нити сами по себе не изменяют длину, а вместо этого скользят друг мимо друга. Это известно как теория сокращения мышц со скользящей нитью.